D Arabinose를 생산하는 방법?
D Arabinitol is an important natural product that is widely found in lichen plants 그리고some food-derived fungi. However, its natural content is low, 그리고it requires a large amount 의raw materials in traditional processes, which seriously affects its economic benefits 그리고makes it unsuitable for large-scale production [1,2]. The chemical catalytic method uses nickel as a catalyst to undergo redox reactions, reducing arabinose to generate D-arabinitol. This is currently the most mainstream method for the industrial production 의D-arabinitol [3]. Although the chemical catalytic method can achieve industrial scale in the marketand the production technology is relatively mature, the production 프로세스requires the use 의expensive catalysts and strict control 의conditions such as high temperature (100°C) and high pressure (40-60 bar) [4]. This not only pollutes the environment but also makes it difficult to separate and purify the subsequent products, resulting in high production costs [5].
화학적 촉매 방법에 비해 D-arabinitol의 생물학적 생산에 필요한 생산 조건이 더 완만합니다.미생물의 성장과 대사에 의해 물질의 전환이 이루어지고, 얻어진 산물은 분리 및 정화가 용이하며, d-아라비니톨의 순도와 수율을 향상시킬 수 있어 [6, 7] 친환경적이고 경제적이며 환경 친화적이라는 컨셉에 더욱 부합한다.생물학적 방법에는 크게 미생물 발효와 휴지 세포 변환 두 가지가 있다.미생물 발효법은 주로 미생물의 성장과 대사 중에 글리세롤, 자일로스, 락토오스, 포도당, 자일리톨 등의 기질을 전환시켜 d-아라비니톨을 생성한다 [8, 9].휴지 세포 형질전환법은 주로 배양된 세균액을 채취하고 농축하여 휴지 세포를 준비하는 것에 의존하며, 휴지 세포 내에 존재하는 다양한 효소를 이용하여 D-arabinitol을 전환한다.
요약하면, D-arabinitol을 생산하는 방법들은 각각 고유한 특징을 가지고 있으나, 생물학적 방법은 미생물의 정상적인 성장과 대사를 통해 물질의 전환이 이루어지기 때문에 친환경적이고 경제적이며 친환경적인 장점이 있다.또한 생물학적 방법의 생성물은 분리 및 정제가 용이하여 D-arabinitol의 순도와 수율을 향상시킨다.아직은 화학적 촉매 방법이 주된 생산 방법이지만 생물학적 방법이 더 유망한 대안이 되었거나 되고 있다.
1. D-arabitol의 생물학적 생산의 현재 연구 현황
고삼투압 내성효모는 d-아라비톨을 생산할 수 있는 자연계의 주요 미생물이다.높은 삼투압 하에서 효모세포는 폴리올을 합성, 축적하여 탈수 스트레스에 대처함으로써 손상으로부터 세포를 보호한다.1956년 스펜서 등은 삼투압에 내성이 있는 효모가 포도당의 발효를 통해 다양한 폴리올을 만들어낼 수 있다는 것을 발견했는데,이 중 D-arabitol[10]이 포함된다.1969년 오니시 등은 포도당이 미생물의 작용으로 자일리톨로 전환될 수 있으며, d-아라비니톨이 중간생성물임을 발견하였다 [11, 12].이 발견은 자일리톨의 생물학적 생산에 이론적 토대를 마련했으며 국내외 학자들의 광범위한 주목을 받았다.
At present, research on the production 의D-arabinitol mainly focuses on strain screening and fermentation condition optimization. For example, Song Weibin et 알다.screened a strain of Saccharomyces cerevisiae that produces D-arabinitol 에서pollen, and improved the conversion rate after optimizing the fermentation conditions [12]. Li Ze et al. isolated a strain of Pichia pastoris L-84 from soil microorganisms that is resistant to high osmotic pressure and produces D-arabinitol, and carried out large-scale fermentation in a fermenter [13]. Saha et al. used a strain of Rhodotorula glutinis NRRLY-27624 obtained by screening from a wild honeycomb to optimize the fermentation conditions and finally achieve the fermentation of glucose to produce D-arabinitol, with a conversion rate of 48% [14][15].
Zhang Lili는 Debaryomyces hansenii 로부터 D-arabitol의 고수율 균주를 성공적으로 분리하고 D-arabitol 발효를 위한 운동 모델을 확립하였다 [16].Nozaki는 D-arabitol을 효율적으로 생산하는 Rhodotorula kofmei AJ14787 균주를 선별하였다.변온재배와 700 g/L 포도당을 연속공급하여 발효 최적화를 수행하였고, 최종적으로 206 g/L[17]를 발효하여 D-arabitol을 생산하였다.Cheng 등은 Pichia pastoris 계통에 적응진화를 적용한 결과, 야생형에 비해 생산량이 72.7% 증가하였다 [18].
M Povelainen 등은 D-arabitol을 생산하는 가공 세균 Bacillus subtilis ATCC31094를 제조하였는데, 전환효율이 최대 38%에 달하여 응용 가능성이 높다 [19].후속 연구자들은 칸 디속 [20], Kluyveromyces 속 [21], Kodamea 속 [22, 23], Hansenula 속 [24, 25], Debaryomyces 속 [26]이 D-arabitol[27]을 생산할 수 있다는 것을 발견하였다.
2. D-arabinitol의 생명공학 생산을 위한 대사 경로
현재 연구에서 포도당과 같은 기질,xylose[28], 글리세롤 [29, 30] 및 락토스 [31]는 d-아라비니톨 생산에 사용될 수 있다.포도당과 자일로스는 자연계에서 상위 2개의 탄소원 매장량 중 하나이며, 따라서 가장 비용 효율적인 기질로 널리 간주된다는 점에 주목할 필요가 있다.기존 연구 보고에 따르면, 포도당으로부터 d-아라비톨을 생산하는 대사 경로는 주로 두 가지 합성 경로를 포함하는 반면, 자일로스에서 d-아라비톨을 생산할 수 있는 대사 경로는 오직 한 가지, 자일리톨 경로만을 가지고 있다.D-arabitol의 세 가지 일반적인 대사 경로가 그림 1.2에 나와 있다.
그림 1.다라비톨의 대사 경로
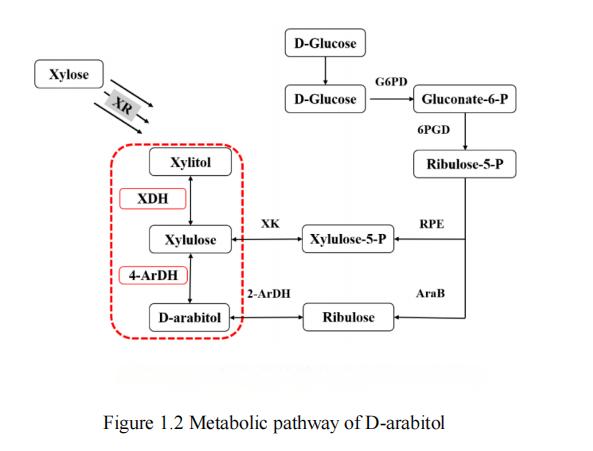
포도당으로부터 다라비톨을 생산하는 대사 과정을 위해 두 가지 합성 경로가 존재하는데, 리불로스 경로와 자일룰로스 경로이다.이 과정에서 포도당은 먼저 글루코스 6-phosphate로 인산화되고, 리불로스와 자일룰로스 경로의 일반적인 전구체인 펜토스 인산 경로 (PPP 경로)를 통해 5-포스-d-리불로스로 전환된다.리불로스 키나아제에 의해 5-포스-d-리보스가 d-리불로스로 전환된 후 2-ArDH에 의해 d-아라비니톨로 전환되면 리불로스 경로를 형성한다.다른 대사 경로에서 5-포스-d-리보스는 d-자일룰로스-5-인산염으로 이성질화된 후 d-자일룰로스로 탈인산화된다.다음으로, d-아라비톨 4-디 하이드로 겐 효소가 전환됩니다d-아라비톨에 자일룰로스, 따라서 자일룰로스 경로 [32]를 형성한다.
자일로스에서 d-아라비톨을 생산하는 대사 경로는 주로 합성 경로인 자일리톨 경로를 포함한다.이 과정에서 자일로스 환원효소는 먼저 자일로스를 자일리톨로 전환시킨다.이어서, 자일리톨 탈수소효소 (xylitol dehydrogenase, XDH)는 자일리톨을 D-xylulose로 환원시킨다.마지막으로 D-arabitol dehydrogenase (ArDH)는 D-xylulose를 D-arabitol로 전환시켜 자일리톨 경로의 합성을 완료한다.
요약하면, 포도당과 자일로스는 생체 공학 분야에서 흔하고 저렴한 두 가지 기질로서 펜토스 인산 경로, 자일루오스 경로 및 자일리톨 경로와 같은 다양한 경로를 통해 d-아라비니톨을 생산하는 데 사용될 수 있다.이러한 대사 경로는 연구자들에게 풍부한 생합성 전략을 제공하며, 이는 d-아라비니톨의 생산 공정을 더욱 탐색하고 최적화하여 실제 응용 분야에서 기능성 당알코올의 요구를 충족하는 데 도움이 될 것입니다.
3. 미생물 발효에 의한 D-Arabinitol 생성에 영향을 미치는 인자
발효과정에서 D-arabinitol의 수율은 다양한 요인에 의해 제한될 수 있다.현재 d-아라비니톨의 수율은 pH, 온도, 탄소 및 질소원 조성, 이노쿨럼 크기, 회전 속도 및 용존 산소 농도 등의 발효 조건을 최적화함으로써 효과적으로 증가시킬 수 있다 [33, 34].이러한 요인들은 생산 숙주의 대사 과정과 밀접한 관련이 있다.이러한 파라미터를 조정함으로써 이상적인 발효 조건을 설정하여 발효 수율을 높일 수 있습니다.
현재 D-arabinitol의 생물학적 생산에 관한 대부분의 연구는 포도당으로부터 D-arabinitol의 발효에 초점을 맞추고 있으며, 자일로스로부터 D-arabinitol의 생산에 관한 연구는 적다.포도당 생장 중에는 많은 효모가 D-arabinitol을 생산하는 것으로 알려져 있으나, 자일로스로부터 D-arabinitol을 생산하는 효모는 거의 알려져 있지 않다.2018년 Jagtap 등 [28]은 Rhodosporidium toruloides IFO0880이 질소가 풍부한 매질에서 자일로스로부터 d-아라비니톨을 생산할 수 있음을 처음 보고했다.이는 천연 효모가 자일로스를 유일한 탄소원으로 이용하여 D-arabinitol을 생산할 수 있다는 사실을 처음으로 밝혀낸 것으로, D-arabinitol의 생물학적 생산 대사과정에 자일리톨 경로가 존재함을 확인하였다.이 과정에서 자일로스는 먼저 자일로스 환원효소에 의해 자일리톨로 전환된다.이어서 XDH에 의해 자일리톨이 D-xylulose로 환원된다.마지막으로 ArDH는 d-자일룰로스를 d-아라비니톨로 변환시킨다.

초기 기질 농도가 높으면 발효 균주에 삼투압이 작용하여 전진 생물전환 반응을 촉진하고 이에 따라 D-arabitol의 수율을 높일 수 있다.예를 들어, Debaryomyces hansenii SBP-1의 발효 중에 150 g/L 자일로스를 사용할 경우 70 g/L 자일로스를 사용할 경우에 비해 D-arabitol의 수율을 2.23배 높일 수 있다.Debaryomyces hansenii NRRLY-7483로 발효하는 동안 1.5% glycerol을 사용하면 0.5% glycerol에 비해 d-아라비톨의 생성을 4~5배 증가시킬 수 있다 [35].Candida sp. H2 [36]의 생장 및 대사 중에 D-arabinitol의 생성은 포도당 농도가 증가함에 따라 유의적으로 증가하였으며, 250 g/L 포도당이 최적의 초기 당 농도였다.그러나 기질 농도가 너무 높으면 D-arabitol 합성에도 해로울 수 있다.예를 들어, Zygosaccharomyces rouxii JM-C46 재배시 포도당 농도가 200 g/L에서 250 g/L로 증가하였을 때 D-arabitol의 생산은 더 증가하지 않았다.
Nitrogen sources are key elements in microbial fermentation systems and are closely related to the regulation of microbial growth and metabolism. For example, the optimal nitrogen source for Candida sp. H2[37] and Candida quercitrusa is yeast extract, while ammonium sulfate is the optimal nitrogen source for Pichia Manchurica[38] and Debaryomyces Hansenii. Kumdam[39] and Loman[40] found that adding an appropriate amount of nitrogen source to the medium can increase the production of D-arabitol. Similarly, Jagtap et al. found that Rhodosporidium toruloides IFO0880 can convert xylose to produce high titers of D-arabitol in nitrogen-rich media. The yield of D-arabitol increased with the increase of nitrogen content in the medium. However, high nitrogen concentrations may be detrimental to the production of D-arabitol by Kluyveromyces ohmeri strains [41].
미생물발효시 적당량의 금속이온을 첨가하면 세포내액의 삼투압균형을 유지하고 세포내효소의 활성을 증진시키며 미생물의 성장과 대사를 촉진할수 있다.요시카와는 Candida quercitrusa에 의한 d-아라비니톨 생성에 대한 금속 이온의 영향을 연구했고 칼슘 이온이 d-아라비니톨의 생성을 촉진한다는 것을 발견했다.그 이유는 칼슘 이온이 세포 안으로 침투하여 세포 성장과 대사 경로에서 효소의 활동을 강화하기 때문입니다.다른 연구에서 Kumdam [42]과 Sundaramoorthy는 아연, 철, 망간 및 구리 이온이 Debaryomyces nepalensis와 Pichia Manchurica 계통의 성장 대사를 촉진하고 D-arabinitol의 생산을 증가시킬 수 있다는 것을 발견했다.
3.1 크실리톨 디 하이드로 게나제
Xylitol dehydrogenase는 D-arabinitol 생산을위한 생합성 경로에서 주요 속도 제한 효소입니다.XDH는 D-arabinitol을 생성하기 위해 미생물에 의한 자일로스의 대사에 중요한 역할을합니다.가역적 산화 환원 효소로서 XDH의 촉매 활성은 보조 인자인 NAD+와 NADH에 의존한다 [43, 44].
This enzyme is mainly found in yeasts that ferment xylose to produce xylitol이를테면 Paecilomyces taphios, Candida shehatae, Pichiastipitis [45] 등이 있다.Fusarium oxysporum과 Neurospora crassa와 같은 실 모양의 균류 또한 XDH의 중요한 원천이다.서로 다른 종에서 나온 이들 XDHs의 활성 중심 서열이 매우 보존되어 있다는 점에 주목할 필요가 있다 [46].
Masakazu 등 [47]은 Gluconobacter oxycans ATCC621에서 XDH 유전자를 복제하였고, Zhang 등 [48]은 Gluconobacter oxycans NH-10에서 XDH 유전자를 복제하였으며, Qi 등 [49]은 Gluconobacter oxycans CGM CC 1.49에서 XDH 유전자를 복제하였다.
이들 연구자들은 서로 다른 균주의 XDH 유전자를 복제하여 Escherichia coli BL21에서 성공적으로 발현시켰다.또한 XDH의 효소적 특성을 연구하여 여러 공급원으로부터 이들 XDHs의 효소적 특성이 어느 정도 유사하다는 것을 발견하였다.추가 연구를 통해 XDH 가 단사 탈수소효소 계열에 속한다는 것이 밝혀졌다.NAD+를 조효소로 하는 자일리톨 산화 반응에서 XDH의 최적 pH는 11;NADH를 조효소로 하는 D-xylulose 환원반응에서 XDH의 최적 pH는 5이다.따라서 산화반응에서 XDH의 최적 pH는 알칼리성 범위이고, 환원반응에서 최적 pH는 산성 범위임을 추론할 수 있다.
요약하자면, XDH는 생물학적으로 중요하다.균주별로 XDH의 효소적 특성은 다양하지만 단백질 서열이나 효소적 성질에 있어서는 모두 어느 정도의 유사성을 공유한다.현재 연구를 통해 XDH는 반응조건에 따라 최적의 pH 값이 다르게 나타났으며, 이는 추후 효소의 연구 및 응용을 위한 기초자료를 제공하고 있다.
4분자 개조
XDH는 다양한 촉매 특성을 가지고 있으며 생체 분해에서 중요한 역할을 합니다.그러나 천연 효소는 활성, 기질 스펙트럼 및 촉매 특이성 측면에서 여전히 한계가 있어 이상적인 수준의 제품 수율을 달성하기가 어렵다.최근 단백질 공학적 전략인 방향진화 (directed evolution), 합리적 설계 (rational design), 반합리적 설계 (semi-rational design) 등이 효소변형에 널리 사용되고 있다.이러한 전략은 효소의 성능을 효과적으로 개선하여 실제 생산 수요를 더 잘 충족시킬 수 있습니다.
5 집-Directed Evolution
프랜시스 H. 아놀드 (Frances H. Arnold) 가 1993년 처음 주도진화론 (directed evolution)의 개념을 제안한 이후,이 분야는 최근 수십 년간 괄목할 만한 발전을 이루었다 [50].효소공학에서 중요한 역할을 하는 방향성 진화의 기본 개념은 자연적인 진화 과정을 시뮬레이션하고, 인공적인 무작위 돌연변이를 도입하고, 고성능 돌연변이를 선별하는 것이다.
또한 directed evolution strategy는 효소의 구조, 기능 및 촉매 메커니즘에 대한 깊은 이해 없이도 효소의 기능을 효과적으로 수정할 수 있다는 장점이 있다.주도적 진화 전략의 주요 단계에는 돌연변이 구축과 돌연변이 라이브러리 선별 작업이 포함됩니다.이 과정에서 랜덤 돌연변이 (random mutation)와 오류가 발생하기 쉬운 PCR, DNA 셔플링 (DNA shuffling) [51] 등의 유전자 재조합 기술을 사용한다.
이러한 기술의 적용으로 돌연변이 구축의 효율과 돌연변이 라이브러리의 다양성이 크게 향상되었다.그러나 방향성 있는 진화 전략의 구현은 특히 처리량이 많은 스크리닝 단계 [52]에서 몇 가지 도전에 직면한다.우수한 돌연변이를 빠르게 식별하고 선별하기 위한 방법으로서 높은 처리량 스크리닝 (High-throughput screening)은 directed evolution 과정에 매우 중요하다 [53].
특정 돌연변이 라이브러리에 대한고 처리량 스크리닝 방법은 대상 제품에 따라 특별히 설계되어야 하므로 보편적인 스크리닝 방법이 없다.이 단계의 심사 과정의 구체적인 설계와 과제는 지시된 진화 전략의 복잡성을 의심할 여지없이 가중시킨다.전반적으로, 고처리량 스크리닝 방법의 구체적인 설계와 도전에도 불구하고, 방향성 진화 기술은 여전히 효소의 분자 공학에 효과적인 도구로 여겨진다.이 분야의 중대한 기여와 지속적인 발전 추세는 생명공학 및 관련 분야에서 계속 중요한 역할을 할 것임을 보여준다.
참조:
[1] 에스 칼 란 테 J, Caminal G, Figueredo M, et al. 생산 of arabitol from gl ucose by Hansenula polymorpha[J. 저널 발효의 and Bioenginee 반지, 1990년, 70 (4):228-231.
[2]Moran J W, Witter L D. Effect of sugar onDarabitol production and glucose metabolism in saccharomyces rouxii[J]에서 당.저널of Bacteriology, 1979,138(3):823-831.
[3] 머시 SN, 금담 H, 금마디 SN.미생물 fermen-tation-biosynthesis에 의한 Arabitol 생산 그리고 향후 응용 프로그램 [J.국제학술지'사이언스기초&응용연구, 2014, 1:1-12.
[4]Kumdam H, Narayana M S, Gummadi S N. Debaryomyces에 의한 에탄올과 아라비톨 생산 nepalensis: 영향을 of 프로세스 매개 변수 [J]. 다 2013년 표현, 3 (1):23.
[5] 장 G, 리니, 헤 P 등.당알코올 생산효모 피치아의 특성 (characteristics of the sugar alcohol-productingyeast Pichia anomala다 [J다] 저널 of 산업 미생물학 & 2014년 생명공학, 41 (1):41-48다.
[6] 황위, 왕샤오단, 리두난 등.D-arabitol [J]의 미생물 발효에 관한 연구 진행.중국양조, 2017, 36(09):6-10.
딩샤오빙, 리종웨이, 양주안친 등.효소를 생산하는 액체 속에 있는 isoleucine의 함량을 알아내기 위한 개선된 종이 크로마토그래피 (J.외식산업과학기술, 2009, 30(08):314-315.
[8] 아키노쇼 H, 라이드작 T, 보롤 A 외.미생물의 바이오에탄올 생산에 대한 독성학적 도전과 내성 향상을 위한 전략.생태독성학, 2015, 24(10):2156-2174.
[9] 취안웨이둥, 닝샤오샤오, 왕란 등.고수율 D-arabinitol 효모 균주의 신속 스크리닝 방법 [J.산시대학논문집 2014(6):129-133.
삼투성 효모에 의한 polyhydric alcohols의 생산 (Spencer J F T, Sallans H R.Canadian Journal of Microbiology, 1956, 2(2):72-79.
[11] Onishi H, Suzuki T. 포도당으로부터 자일리톨의 미생물 생산 [J].응용미생물학 (적용Microbiology), 1970, 18(6):1031-1035.
[12] 송웨이빈, 린옌칭, 후하이옌 외.D-arabitol 생산 균주의 선별 및 동정 및 D-arabitol 생산 조건의 최적화 [J. 「 Acta Microbiologica Sinica 」, 2011, 51(03):332-339.
[13] 리제, 자오상잉, 류잔준.D-arabinol을 생산하는 효모 균주의 스크리닝 및 동정 (J.외식산업, 2012, 33(10):27-30.
[14]Guo Q, ZabedH, Zhang H 등.신규 분리한 효모 균주 (Zygosaccharomyces rouxii JM-C46)의 발효매체 최적화 및 생합성에 영향을 미치는 인자의 평가 (evaluation of fermentation medium for a newly isolated yeast strain, Zygosaccharomyces rouxii JM-C46)식품 과학 &기술, 019,99:319-327.
[15]Saha B C, SakakibaraY, Cotta M a. 생산 ofDarabitol by a newly isolated Zygosaccharomyces rouxii[J].Journal of 산업미생물학and Biotechnol-ogy, 2007,34(7):519-523.
[16] 장릴리.고수율 D-arabinitol 효모 균주의 스크리닝 및 발효조건 연구 [D.장난대학교, 2009.
[17] 노자키 H, 스즈키 S, 츠요시 N 등.Metschnikowia reukaufii의 다라비톨의 생산 AJ14787다 [J다] 한국생명, 생명공학 and 생화학, 2003년 67 (9):1923-1929.
[18] 청 H, Lv J, 왕 H 외.포도당을 자일리톨로 전환하기 위해 피치아파스토리스 효모를 단일 발효 공정으로 유전자 조작하였다 [J.응용미-crobiology and Biotechnology, 2014,98(8):3539-3552.
[19] 정 S, 장 B, 장 T 등.Combined mutagenesis and metabolism regulation to enhanceDarabitol production from Candida parapsilosis[J] (캔디다 파라silosis)인더스 저널-시험미생물&생명공학, 2020년 47 (4):425-435.
[20] Wang L, Hui M, Yin Y 등.고생산성 D-arabitol 균주의 분리 및 선별 [J.한국식품안전 및 품질시험학회지, 2014, 5(12):4018-4025.
[21] Toyoda T, Ohtaguchi K. Effect of temperature on Darabitol production from lactose by Kluyveromyces lactis (J.한국산업미생물생명공학회지, 2011, 38(9):1179-1185.
[22] 카이리, 장양, 주홍양 외.D-arabitol을 생산하는 균주의 분리, 선별 및 동정 (J.식품과 발효산업, 2009, 35(01):23-26.
[23] Saha B C, Cotta S M a. 새로 분리한 Zygosaccharomyces에 의한 d-arabitol 생산 rouxii다 [J다] Journal of Industrial 미생물학 & 2007년 생명공학, 34 (7):519-523이다.
[24] 취안웨이둥, 닝샤오샤오, 자오데즈 등.한세누라 다형체의 발효를 개선하여 D-arabitol을 생산하는 조합 전략 [J.Anhui Agricultural Science, 2014, 42(23):7726-7728.
[25] 왕강, 탕샤오팡, 장궈둥.Hansenula anomala에 의한 아라비톨로의 포도당 전환에 관한 연구 (J.Shipin Gongye Ke-Ji, 2012(1):314-317.
[26] Zhang Lili, Liao Defang, Ding Chongyang 등.Hansenula polymorpha에 의한 포도당을 발효하여 D-arabitol [J]을 제조하였다.산업미생물학, 2010, 40(04):47-52.
[27] 두위안.Pichia pastoris의 대사공학과 D-arabinitol [D]의 생합성.2022년 장수대학.
[28] 자그탭 S S, Rao C V. oleaginous 효모 Rhodosporidium toruloides IFO0880[J]에 의한 ofDarabitol fromDxylose 생산.한국미생물학회, Applied Microbiology and Biotech-nology, 2018,102(1):143-151.
[29] 요시카와 J, 하베, 모리타 T 등.by raw glycerol에서 ofDarabitol 생산 Candida quercitrusa다 [J다] Applied Microbiology and 2014년 생명공학, 98 (7):2947-2953.
[30] 왕후일안, 양리완, 나수민 외.고삼투압 저항성을 갖는 효모에 의한 glycerol과 arabitol의 생산에 관한 연구-iii.Zygosaccharomyces chevalieri Guill에 의한 glycerol의 생산조건 2.309 [J.Acta Microbiologica Sinica, 1963(02):92-93.
[31] Toyoda T, Ohtaguchi K. Role of lactose on Kluyveromyces lactis grown on lactose (J.한국미생물학회지 (Applied Microbiology and Biotechnology), 2010, 87(2):691-701.
[32] 쑨원타오, 쑤후이, 류잔준.첨가제가 D-arabitol의 발효에 미치는 영향 (Effect of additives on the fermentation of D-arabitol [J.식품과학과 기술, 2013, 38(06):12-16.
[33] 키 X, 장 H, 마고챠 T A 등.분리된 Gluconobacter sp. JX-05로부터 novelDarabitol dehydrogenase를 발현시키고 전세포의 co-bi-otransformation을 통해 자일리톨 생산을 향상시켰다 [J.바이오사우어 테크놀로지 (Bioresour Technology), 2017,235:50~58.
[34]Ravikumar Y, Ponpandian LN, Zhang G 외.ofDtagatose 생물학적 생산을 위한 l-arabinose 이성질화효소 활용:최근의 진보와 그 응용 [J].식품과학&의 동향기술, 2021년 107:16-30다.
[35]Koganti S, Ju L. Debaryomyces hansenii fermentation for arabitol production[J.생물화학공학회지 2013년,79:112-119.
[36] 송웨이빈, 린옌칭, 후하이옌 외.D-arabitol 생산 균주의 선별 및 동정 및 D-arabitol 생산 조건의 최적화 [J.「 Acta Microbiologica Sinica 」, 2011, 51(03):332-339.
[37] 송웨이빈, 린옌칭, 후하이옌 외.Isolation and identification of a novel Candida sp. H2 producingDarabitoland optimization ofDarabitol production [J.위현우슈바오, 2011,51(3):332-339.
[38]Sundaramoorthy B, Gummadi SN.arabitol 생산을 위한 new 효모 Pichia manchurica의 Screening.기초미생물학회지 2019년,59(3):256-266.
[39]Kumdam H, Narayana M S, Gummadi S N.의 Debaryomyces nepalensis에 의한 에탄올 및 arabitol 생산: 영향을 공정변수 (process parameters)의 [J]다. 다 2013년 표현, 3 (1):거 워 한다.
[40]Loman A A, Islam S, Ju L K. Production of arabitol from enzyme hydrolysate of soybean 밀가루에 의한 Debaryomyces hansenii fermentation (J.한국미생물학회지 Applied Microbiology and Biotechnology, 2018,102(2):641-653.
[41] 주 H이, 수 H, 다이 X이 등.새로 분리한 Ko-damaea ohmeri[J]에 의한 ofDarabitol 생산.바이오공정 및 바이오시스템공학 (Bioprocess and Biosystems Engineering), 2010,33(5):565-571.
[42] 금담 H, 머시 S N, 금마디 S N. Debaryomyces에 의한 에탄올과 아라비톨 생산 nepalensis: 영향을 of process 매개 변수 [J]. 다 2013년 표현, 3 (1):컷다.
[43]Ehrensberger AH,EllingRA, Wilson DK.크실리톨 디 하이드로 genase cosubstrate 특이성 [J]의 구조 유도 공학.구조, 2006년, 14 (3):567-575다.
[44] 위안준화.Clostridium butyricum의 1,3-propanediol dehydrogenase와 1,3-propanediol [D]의 전세포 생합성에 기초한 유전자 조작 박테리아의 제조.장 쑤 대학이다.
[45] 천가연, 예카이, 투즈둥 등.xylitol dehydrogenase [J]의 연구 진행.양조과학기술, 2011(5):4.
[46] 장환환.Gluconobacter oxydans 로부터 xylitol dehydrogenase와 ethanol dehydrogenase 유전자의 Cloning과 발현 및 xylitol [D]의 전세포 생합성.장수대학, 2018.
[47] 스기야마 M, 스즈키 S, 토노우치 N 외.Gluconobacter oxydans 로부터 xylitol dehydrogenase 유전자의 Cloning과 xylitol fromD의 생산 개선 arabitol다 [J다]「 생명공학, Biotechnology and Biochemistry 」, 2003,67(3):584-591.
[48] 장 J,리 S, 수 H 외.xylitol dehydrogenase의 정제 및 Glucono-bacteroxydans의 XDH 활성과 NADH 공급을 증가시켜 xylitol의 생산을 개선하였다 (J.한국농식품화학학회지, 2013,61(11):2861-2867.
[49] 키 X, Zhu J, Yun J 외.향상된 자일리톨 생산:Gluconobacter oxydans와 휴지 세포 [J]의 혼합 배양으로부터 자일리톨 dehy-drogenase의 발현.jour-nal of Bioscience and Bioengineering, 2016,122(3):257-262.
[50] 펭이다.스테로이드 P450 dihydroxylase CYP-cl3의 향상된 촉매 효율의 분자 개량 및 메커니즘 분석 [D].2022년 장난대학.
[51] 루오얀.부제:Cloning and co-expression of arabitol dehydrogenase and xylitol dehydrogenase genes of Gluconobacter thailandicus D [D].장수대학교, 2016.
[52] 장 유페이.Lactobacillus reuteri에 의한 3-hydroxypropionic acid와 1,3-propanediol의 공동생산에 관한 연구 [D].2021년 장쑤대학.
[53] 위안자오.건설에 유전자 변형 박테리아를 기반으로 한 β-galactosidase과 L-arabinose isomerase과 biosynthesis D-tagatose의 [D]다.2021년 장쑤대학.


 영어
영어 프랑스
프랑스 스페인
스페인 러시아
러시아 한국
한국 일본
일본