D 타가토스 분말의 합성까지의 방법?
인간은 하루 세 끼 식사에 설탕 없이는 할 수 없다.적당한 양의 설탕을 먹는 것은 신체의 필요를 충족시킬 뿐만 아니라 ', s의 기능을 하면서도 행복감을 가져다준다.그러나 생활수준의 향상으로 당분을 과다 섭취하게 되고, 이로 인해 비만, 당뇨병, 충치, 심장병 [1]등의 질병 유병률이 증가하게 되었다.최근 들어 흡수량이 높고 칼로리가 높은 전통적인 당 (자당, 백당, 포도당 등)은 칼로리가 낮고 흡수량이 낮은 희귀당 (자일리톨, 에리트리톨, d-알룰로스 등)으로 점차 대체되고 있다.국제희귀당학회 (ISRS)는 희귀당을 자연계에 존재하지만 매우 적은 양 [3]으로 존재하는 단당류 및 그 유도체의 한 종류로 정의한다.레어설탕은 단맛이 날 뿐 아니라 칼로리도 낮다.더욱 중요한것은 인체건강에 이롭고 발전전망이 큰 생리기능을 갖고있다는것이다.
Rare sugar D-tagatose, 분자식 C6H12O6, 분자량 180.16으로 그림 1과 같은 구조식을 갖는다.d-갈락토스의 이성질체, C-3위치에 d-소르비톨의 이입체 이성질체, C-4위치에 d-과당의 이입체 이성질체이다.그것은 백색 결정 과립 또는 백색 분말, 물에 쉽게 용해, 에탄올에 약간 용해.수크로스 [4]의 92%에 달하는 단맛과 1.5 kcal/g[5]의 열량을 가진 자연발생적인 저칼로리 기능성 감미료이다.d-타가토스는 미국 식품의약국 (FDA) 으로부터 안전한 (일반적으로 안전한 것으로 인정, GRAS) 성분 [5-7]으로 승인받았다.2014년 차이나's 국가 보건 및 가족 계획 위원회는 d-타가토스를 새로운 식품 성분으로 승인했다 [6].d-타가토스는 충치와 비만을 예방하고 혈당을 낮추는 효과가 있을 뿐만 아니라 [8]장 건강에도 이로운 효과가 있다.
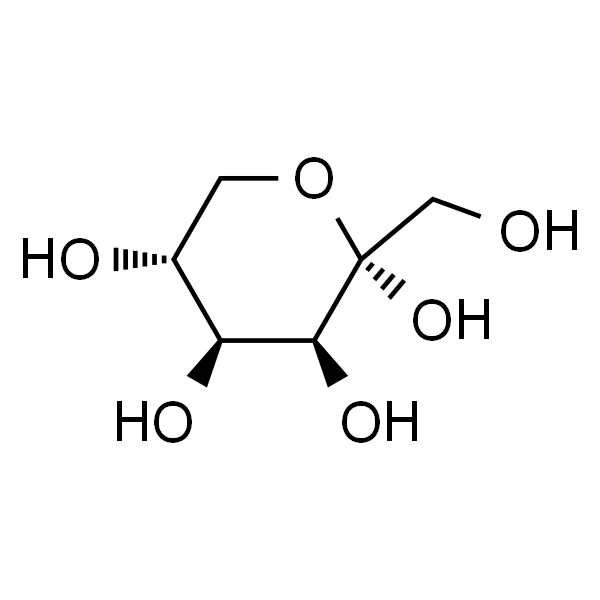
이 글에서는 d-타가토스의 생리학적 기능과 응용을 간략히 설명하고, d-타가토스의 생합성에 필요한 주요 생물학적 효소를 소개하며, 최근 d-타가토스 생합성의 연구 진전을 요약하고, d-타가토스의 생합성에 대한 전망을 제공한다.
d-타가토스의 생리적 기능 및 응용 1
1.1 마이야르 반응을 거쳐 식품에 사용될 수 있는 저칼로리 감미료
D-tagatoseis a low-calorie sweetener. It is 92% as sweetas sucrose, but only 37.5% as 높은에서calories (4kcal/g) [5]. It c한react 와proteins in food 을form a Maillard reaction, which improves 이colour 그리고flavour 의이food. It is therefore used in baked goods, drinks 그리고confectionery.
1.2 비만을 예방하고 혈당을 낮추며 제2 형 당뇨병의 치료를 돕는다
d-타가토스는 저칼로리 기능성 감미료로 자크로스와 같은 전통적인 감미료를 대체하기 위해 식품에 사용될 수 있다.비만을 완화시키고 혈당을 낮출 수 있다 [9].의학 및 의료 분야에서 d-타가토스는 제2 형 당뇨병 및 비만 치료를 위한 약물을 준비하는 데 사용될 수 있다 [10-12].
장 건강에 이로운 1.3 탁월한 프리바이오틱
d-타가토스는 대장에서 장내 균에 의해 발효될 수 있으며, 유익한 장내 세균의 성장을 촉진하고 장 내 병원성 세균의 성장을 억제한다 [13].또한 d-타가토스를 발효시키면 뷰티르산과 같은 단쇄 지방산이 생성될 수 있어 장 건강에 도움이 된다.이러한 산은 대장 상피세포의 성장과 번식을 촉진하고 대장암의 발생을 억제할 수 있다 [14].
1.4 안티캐리제, 치아건강을 지키는데 이롭다
d-타가토스는 구강 내 미생물이 이용할 수 없기 때문에 구강 내 산성 물질의 생성을 줄이고 충치를 감소시켜 치은염, 충치, 구취 등의 치아 질환의 발생을 효과적으로 예방하는데 도움을 준다 [13].

1.5는 다른 희귀 당 알코올을 생산하는 기질로 사용됩니다
헥소스를 생산하기 위한 생물형질전환 전략, 즉, d-타가토스로부터 시작되는 이즈머링 전략 [15]에 따르면, 적합한 효소 촉매작용을 통해 d-소르비톨, d-타가토스, 갈락티톨과 같은 중요한 생리적 기능을 가진 희귀 당알코올을 얻을 수 있다 (그림 2).
d-타가토스의 생산 방법 2
2.1자연 추출법
자연계의 d-타가토스는 열대 상록수, 이끼, 이끼, 핫 코코아, 치즈, 요구르트 등의 잇몸에서 주로 발견되며, 함량은 매우 작다 [13, 16, 17].이러한 물질에서 d-타가토스를 직접 추출하려면 많은 양의 원료가 필요하므로 원가가 매우 높고 d-타가토스의 산업적 생산을 달성하기가 어렵다.
2.2 화학 합성법
d-타가토스는 d-갈락토스로부터 화학 합성을 통해 얻을 수 있다.사용된 화학 촉매는 알칼리 금속염으로, d-갈락토스의 이성화 반응을 촉매하여 금속 수산화물과 d-타가토스 복합체를 형성한다.산 중화 후, 복합체는 d-타가토스 [13, 14, 18]를 분비한다.그러나 d-타가토스를 생성하기 위한 화학적 합성방법은 비교적 복잡하고, 부산물을 생성하기 쉬워 목표 생성물인 d-타가토스의 순도를 떨어뜨리고 나중에 분리 및 정제하기가 불편하다.게다가 화학시약을 사용하면 환경 부담이 생기고 [19] 친환경 생산 개념과도 맞지 않는다.
2.3 생합성 방법
하는 두 가지 주요 방법이 있다생물학적으로 d-타가토스를 합성한다:하나는 단일 효소 반응을 이용하여 d-타가토스를 합성하는 것이고, 다른 하나는 다중 효소 반응을 이용하여 d-타가토스를 합성하는 것이다.이즈머링 전략 (그림 2)에 따라, d-갈락토스, d-소르비톨과 갈락티톨을 각각 d-타가토스로 전환하는 촉매로 적절한 단일 알를로스 이성화 효소, d-타가토스 3-에피머라제 및 환원효소를 선택할 수 있다.그러나 d-갈락토스, d-소르비톨, 갈락티톨의 비교적 높은 가격은 산업생산에 적용하기 어려워 d-타가토스의 산업적 생산을 제한한다.현재 일부 연구자들은 락토오스, 말토덱스트린, 밀크 유장 분말과 같은 저가 기질을 출발 물질로 선택하고, 다중 효소 촉매 반응을 이용하여 d-타가토스를 합성하였으며, 일부 연구 성과를 거두었다.d-타가토스를 생산하는 생합성 방법은 생산 효율이 높고, 생성물의 순도가 높으며, 반응 조건이 온화하고, 비용이 저렴하다는 장점이 있어 d-타가토스의 산업 생산에 선호되는 방법이다 [20].
단일 효소반응에 의한 d-타가토스의 합성 3
3.1 l-아라비노스 이성질체는 d-갈락토스의 d-타가토스로의 합성을 촉매한다
희귀당을 생합성하는 단일효소법은 효소의 물리화학적 특성을 충분히 이용할 수 있으며 희귀당 생산에 응용된다.간편하고 효율적이며, 효소촉매의 활용도가 높고, 생산효율이 높은 장점이 있다.L-arabinoseisomerase(L-AI)는 d-타가토스의 생합성을 위해 현재 가장 많이 연구되는 효소이며, d-갈락토스를 d-타가토스로 촉매할 수 있다.
이 효소는 AcidothermuscellulolyticsATCC43068[21], 대장균subtilis str. 168[22], Lactobacillus sake i 23K[23], Lactobacillus fermentum 등 다양한 미생물 원이 있다 CGMCC2921[24], 바실러스 thermoglucosidasius KCTC 1828년 [25], Alicyclobacillus hesperidum URH17-3-68[26], 대장균coagulans NL01[27], Pseudoalteromonas haloplanktis ATCC14393[28], Geobacillus stearothermophilus [4], 클 로스 hylemonae DSM 1505 3[29], Lactobacillus brevis MF 465792[30], Enterococcus faecium DBFIQ E36[31], Bifidobacterium adolescentis CICC 6178[32], Klebsiella pneumoniae DSM 681[33] 등.
The enzymatic properties 의L-arabinoseisomerase에서이above microorganisms are shown in Table 1. The optimum reacti에temperature is between 40-75 ℃, 이optimum reacti에pH is between 5.0-8.0, 그리고various metal ions are activators 의the enzyme, such as Mn2+, Co2+, and Mg2+. Most L-AIs have 기질특이성을L-arabinoseand D-galactose, while a small number have substrate specificity only 을L-arabinoseand no substrate specificity 을D-galactose, such as L-AIs 에서Bacillus subtilis str. 168[22] and Pseudoalteromonas haloplanktis ATCC 14393[28]. specificity, such as L-AI 에서Bacillus subtilis str. 168[22] and Pseudoalteromonas haloplanktis ATCC 14393[28]. In addition, L-AI enzymes 에서Acidothermus cellulolytics ATCC43068[21], Lactobacillus sakei 23K[23], Lactobacillus fermentum CGMCC2921[24], Bifidobacterium adolescentis CICC 6178[32], etc. exhibit strong substrate specificity 을D-galactose.
Bacillus coagulans NL01로부터 L-AI는 대장균 발현 시스템에서 이형적으로 발현되어 60 °C와 pH 7.5에서 전세포에 의해 촉매되었다.기질인 d-갈락토스의 농도가 150 g/L 및 250 g/L 일 때, 결과물인 d-타가토스의 전환율은 각각 32% 및 27%, 전환시간은 각각 32 및 48시간이었다 [27].d-타가토스 전환율은 100 mmol/L d-갈락토스 (6 mmol/L Mn2+ 함유)를 Bifidobacterium CICC 6178이 adolescentis 가 되는 L-AI 효소로 55 °C,pH 6.5에서 10 h 동안 촉매하였을 때 56.7% 이었다 [32].Klebsiella pneumoniae DSM 681의 L-AI는 대장균 발현 시스템에서 이질적으로 발현되었다.기질은 100 g/L D-galactose(1 mmol/L Mn2+ 함유)를 사용하였다.전세포 촉매 반응은 50 °C, pH 8.0에서 30분간 수행하였으며, d-타가토스의 전환율은 33.5% [33]였다.
포자 표면 표시 기술은 포자 외피 단백질의 고정 효과에 의존하여 목표 효소와 포자 외피 단백질을 융합시켜 효소를 고정시킴으로써 목표 효소를 포자 표면에 표시하는 방법이다.고정화 효소는 극한의 환경에서도 촉매 활성을 유지할 수 있으며 [10] 막을 통해 기질과 생성물 투과의 장벽을 극복할 수 있다.그것은 효소 고정화에 대한 유익한 시도이다.2014년에는 류 등 16은 포자 표면 표시 기술을 이용하여 Lactobacillus fermentum CGMCC2921의 L-AI 효소를 Bacillus subtilis 168포자의 표면에 표시하였다.얻어진 재조합 L-AI 포자는 상대적으로 높은 촉매 활성과 강한 열적 안정성을 보였다.80 °C에서 30분간 보관한 후에도 87%의 효소활성을 유지하였다.
이 재조합 L-AI 포자를 생체 촉매로 사용하여 100 g/L d-갈락토스를 기질로 사용하고, 70 °C에서 24시간 동안 반응을 수행하여 d-타가토스의 전환율이 약 75% 이었다.2018년 GUO 등 [10]도 Lactobacillus brevis PC16에서 추출한 L-AI 효소를 Bacillus subtilis DB403포자의 표면에 전시하기 위해 spore surface display 기술을 사용했다.재조합 L-AI 포자를 생체촉매로 사용하였다.125 g/L d-갈락토스 (1 mmol/L Mn2+ 함유)를 기질로 사용하여 6 7 °C, pH 6.5에서 28 h 동안 반응을 수행한 결과 d-타가토스의 전환율은 79.7% 였고, 재조합 L-AI 포자는 재사용성이 우수하였다.5주기 후에도 특정 활성은 여전히 87% 였고, d-타가토스의 전환율은 40.7%였다.포자 표면 디스플레이 기술은 포자 수율이 낮아 산업적으로 적용하기 어렵다는 단점이 있다.하기 표 2는 상술한 d-갈락토스로부터 d-타가토스의 촉매 합성에 관한 문헌 보고를 요약한 것이다.
열역학적 평형의 한계로 인해 이성질체 촉매 반응은 전환율이 낮아 생산 효율을 떨어뜨리고 제품의 분리 및 정제에 도움이 되지 않는 특징이 있다.비록 반응온도를 높이면 반응평형을 제품측으로 전환시킬수 있지만 지나치게 높은 온도는 효소활성을 감소시킬뿐만아니라 쉽게 당분을 갈색으로 만들어 특히 알칼리성 조건에서 제품품질에 영향을 준다.따라서 낮은 반응 온도, 산성 반응 pH,높은 촉매 활성 및 강한 내열성을 갖는 효소 촉매의 개발은 산업 분야에 도움이 될 것입니다.
3.2 d-타가토스 3-epimerase는 d-소르비톨로부터 d-타가토스의 생산을 촉매한다
D-tagatose3-epimerase (D-tagatose3-epimerase, DTE) 또는 D-psicose 3-epimerase (D-psicose 3-epimerase, DPE)는 D-psicose의 생합성을 위해 일반적으로 사용되는 효소이다.그들은 광범위한 기질 특이성을 가지고 있습니다.예를 들어 Agrobacterium tumefaciens[34]와 Arthrobacter globiformis[35]의 DPE 효소와 Caballeronia fortuita[36]의 DTE 효소는 모두 d-소르비톨과 d-타가토스 사이에서 전환될 수 있는데,이 경우 Caballeronia fortuita의 DTE 효소에 의해 생체 촉매 작용을 할 때 평형의 d-타가토스와 d-타가토스의 비율은 30.7:69.3이다 (그림 3). 그러나 이를 만드는 d-소르비톨의 높은 가격 때문에 d-소르비톨로부터 d-타가토스 생산의 촉매작용에 대한 연구는 거의 이루어지지 않았다d-타가토스의 공업적 생산 에서D-sorbitol uneconomical.
3. 3 갈락티톨 탈수소효소는 갈락티톨로부터 d-타가토스의 생성을 촉매한다
갈락티톨 2-탈수소효소 (Galactitol 2-dehydrogenase, GDH)는 조효소 NAD+의 존재 하에 다양한 다알코올과 폴리올을 각각 해당 케톤과 케토스로 산화시킬 수 있다.JA GTAP 등 [37] Rhizobium leguminosarum bv 로부터 GDH 효소를 이질적으로 발현시켰다.대장균 발현 시스템에서 viciae 3841.
GDH 효소 단백질을 His-tag affinity chromatography를 이용하여 정제하였다.Sodium dodecyl sulfate-polyacrylamide gel 겔 전기영동을 이용하여 효소의 분자량을 28 kDa로 확인하였고, 겔 여과 크로마토그래피를 이용하여 114 kDa로 확인함으로써 효소가 homotetramer 임을 알 수 있었다.효소적 특성 분석 결과 최적 온도는 35 °C, 최적 반응 pH는 9.5로 나타났다.기질이 갈락티톨일 때 운동파라미터 Km은 8.8 mmol/L,Kcat은 835 min-1, Kcat/Km은 94.9 min-1mmol·L-1로 나타나 효소가 갈락티톨에 대한 기질 특이성이 좋은 것으로 나타났다.G DH 효소는 갈락티톨의 반응을 30분 동안 촉매하며, d-타가토스의 전환율은 72%나 된다.산화 생성물이 d-타가토스임을 광학적 회전을 측정하여 확인한다.
갈락티톨 탈수소효소를 이용하여 갈락티톨로부터 d-타가토스의 생산을 촉매로 하여 높은 d-타가토스 전환율을 얻을 수 있지만, 이러한 산화반응을 위해서는 조효소인 NAD+를 첨가해야 하며, 기질인 갈락티톨은 가격이 비싸기 때문에 산업생산의 원료로서 경제성이 없다.
4 다중 효소 촉매에 의해 저렴한 기질로부터 d-타가토스의 합성을 촉매
4. 1 유당으로부터 d-타가토스의 생성을 촉매
락토스는 d-포도당 1분자와 d-갈락토스 1분자로 구성된 이당류이다.가격이 d-갈락토스, d-소르비톨, 갈락티톨보다 훨씬 낮기 때문에 d-타가토스의 생산에 선호되는 기질이다.Zhang 등 [38]은 Lactiplantibacillus plantarum을 만들었다 갈락토키나아제 유전자를 탈락시켜 d-갈락토스 대사를 차단하는 공병균주;그것은 또한 표현 β-galactosidase (β galactosidase 발음, β-GAL)과 L-arabinoseisomerase, 어느 catalyzes D-galactose을 D-tagatose, 그렇게 함 으로써 달성의 직접적인 biosynthesis D-tagatose 유당에서 냄비 하나에서이 조작 된 변종이 사용 되었를 활용 한다. 65세에 휴식기 셀 반응 56 h를 위한 7. 5 ° C 및 pH의 기질을 가 진 175 g/L 유당, 그리고 D-tagatose의 전환 율 33%이었다.
4. 2. 유장 분말로부터 d-타가토스의 촉매 생산
낙농업 폐기물은 값싼 원료로 사용되어 희귀한 설탕 제품을 생산한다 [39, 40].2022년, 장 et알다.[41]의 변환을 보고 lactose-rich 유제품 부산물, 치즈 유장 파우더 (CWP), 세 감미료,으로 D-tagatose, D-arabitol 그리고 galactitol, 연속 촉매작용 whole-cell과 발효 (Fig. 4)다. 첫째, 대장균 조작 한 변종 co-expressing β-galactosidase과 L-arabinoseisomerasehydrolyze 하기 위해 사용 되었에 CWP 유당을 D-galactose와 포도당 isomerize D-tagatose D-galactose하다.이어서 d-포도당과 남은 d-갈락토스를 Metschnikowia pulcherrima E1에 의해 d-아라비톨과 갈락티톨로 발효시킨다.마지막으로 68.35 g/L d-타가토스,60.12 g/L d-아라비톨및 428.57 g/L CWP (300 g/L 유당 함유)를 사용하여 28.26 g/L 갈락티톨을 얻었다.이 보고서는 또한 중간 대사산물인 d-포도당과 잔여 d-갈락토스의 완전한 이용에 성공하여 산업 부산물로부터 일련의 가치 있는 산물을 생산하였다.
4.3말토 덱스트린으로부터 d-타가토스의 촉매 생산
20년 22년, DAI et알다.[42]로 구성 된 시스템을 구축 α-gluc한phosphorylase (α-glucan phospho-lyase, α GP), phosphoglucomutase (PGM), 포도당 6-phosphate isomerase(PGI), D-tagatose 1, 6-bisphosphate aldolase (개 츠), 그리고 phosphoglycolate phosphatase (PGP)이다.대장균의 전세포 생체 촉매로 구성된 phosphatase (PGP).CRISPR-Cas9기술은 더 나아가 중간생성물의 대사를 일으키는 유전자를 제거하여 중간생성물의 축적을 증가시키기 위해 사용되었다 (그림 5).그 결과 제조된 대장균 균주를 생체 촉매로 사용하여 3 h 동안 10 g/L maltodextrin을 기질로 사용하여 33.83 g/L의 전환율로 3.383 g/L D-tagatose를 얻었다.
Multienzyme promoted reactions have gre에서potential in terms 의biosynthesis and conversion. Compared with single-enzyme-promoted reactions, multi-enzyme-promoted reactions can achieve more complex reactions, 생산high value-added products 에서low-cost substrates, avoid the 분리of intermediates, reduce the inhibition of intermediates, and even change the reaction balance [5]. However, due 을the unbalanced ratio of various enzymes, the unbalanced metabolic flux of intermediates, and the different optimal reaction conditions of various enzymes, the 변환rate D-tagatose의is not high. In the later stage , it is possible to use techniques such as synthetic biology, metabolic engineering, and protein engineering to optimize enzyme synthesis and 표현,improve enzyme performance, increase the synergy between various enzyme molecules, and improve the conversion rate of D-tagatose.
5 d-타가토스 분리, 정제 및 결정화
d-타가토스 분리 및 정제는 d-타가토스의 이후 결정화와 제품 품질에 영향을 미치는 중요한 단계입니다.2008년 황원하 등 [43]은 Ca2+ 이온교환수지를 사용하여 d-갈락토스와 d-타가토스를 분리하였으며, 얻어진 d-타가토스의 순도는 98%, 회수율은 83%;이후 얻어진 d-타가토스 용액을 음이온 및 케이션 교환수지에 가하여 담수 및 탈색하였으며, 담수율은 93%, d-타가토스 회수율은 87%로 나타났다.이어서 에탄올을 첨가하여 d-타가토스를 결정화하였다.Su Qi 등은 모의 이동층 크로마토그래피를 이용하여 d-타가토스와 d-갈락토스를 분리하였고 밸브 교환시간이 6.43분일 때 분리를 통해 얻은 d-타가토스의 순도는 100%에 달하였고, 회수율은 99.93%에 달하였다 [44].최근 모사 이동층 크로마토그래피는 높은 분리 효율, 높은 용매 이용 및 낮은 에너지 소비라는 장점으로 인해 희귀당 생산에 널리 사용되고 있다.
At present , there have been few reports on the 결정 화of D-tagatose. The biosynthesis D-tagatose의is prone to the 생산of other heterosaccharides (such as D-glucose, D-fructose, etc.), and they often cannot be completely removed during industrial separation, which affects the nucleation and growth of D-tagatose crystals, as well as the morphology, particle size distribution and purity of D-tagatose crystals. In 2022 , 왕et알다.[45] studied the effect of three impurity 설탕(D-maltose, D-fructose, and D-glucose) on the nucleation rate of D-tagatose crystals and found that the adsorption 의 불순 해sugars on the surface of D-tagatose crystals hinders the growth of D-tagatose crystals (Figure 6). WANG et알다.also studied the effect of impurity sugars on the growth rate of D-tagatose crystals through single crystal growth experiments, and used molecular dynamics simulations to reveal the crystal nucleation and growth mechanism of D-tagatose at the molecular scale. There are currently few reports on the industrial crystallization process of D-tagatose.
요약 및 전망 6
As a functional natural sweetener, D-tagatose not only has important application value in the food industry, but also plays a vital 역할in the pharmaceutical and healthcare industries. Although D-tagatose has been approved as a new food ingredient in China, large-scale production has not yetbeen realized for the following reasons: (1) an enzyme catalyst with high production intensity, strong thermal stability and high conversion rate has not yetbeen obtained; (2) insufficient development of food-grade host bacteria; (3) high substrate cost; (4) high difficulty in product separation and purification.
위의 이유를 고려하여 다음과 같은 연구에 집중하는 것이 좋습니다:(1) 단백질 공학, 효소 공학 및 기타 기술을 사용하여 효소의 분자 구조를 수정하여 높은 촉매 활성, 높은 전환율 및 높은 열 안정성을 갖는 효소 분자를 얻도록 합니다;(2) Bacillus subtilis, 효모효모, 젖산균 등을 포함한 생물촉매 전달체로서 GRAS 인증을 받은 식품급 숙주균을 개발한다;(3) 생합성과 변환에서 다중 효소 촉매의 잠재력을 최대한 발휘하고, 다양한 효소 분자의 발현 수준과 중간 대사의 흐름을 균형있게 하며, 다양한 효소 분자 간의 시너지 효과를 높이고, 저가 기질을 사용하여 d-타가토스를 대량 생산한다;(4) d-타가토스의 분리, 정제 및 결정화 과정을 최적화한다.상기의 노력을 통해 d-타가토스의 산업 생산을 위한 간단하고 효율적이며 혁신적인 공정 루트가 구축되었습니다.
참조:
[1] SURAPUREDDI S,ravindranath K, KUMAR G, etal.capillary electrophoresis를 이용한 d-tagatose 및 공정 관련 불순물에 대한 고해상도 및 고처리량 분석 방법 [J.Analytical Biochemistry, 2020, 609:11398 1.
[2] BAPTISTA S, ROMANIA, OLIVEIRA C, 외.갈락토오스 to tagatose isomerizationfrom Bacillus subtilis:a biorefinery approach for gelidium sesquipedale valorisation[J].LWT-Food Science and Technology, 15, 2021,151:112199.
[3] BEERENS K, DESMET T,SOETAERT W. 「 enzyme for the biocatalytic production of rare sugar 」 (J.한국산업미생물생명공학회지, 2012, 39(6):823-834.
[4] LAKSMI F, ARAI S, TSURUMARU H, et 알다. 개선 substrate specificity for D-galactose of L-arabinose isomerase for 산업 응용 [J.Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2018, 1866(11):1084-1091.
[5] DAI Y,리M,JIANG B 외.maltodextrin 으로부터 D-tagatose의 전세포 생합성 (Whole-cell biosynthesis of maltodextrin by engineered Escherichia coli with multi-enzyme co-expression system)효소와 미생물 기술, 2021, 145:109747.
WANG J. 감미료 d-타가토스의 생산과 식품에의 응용 [J.중국조미료, 2016, 41(01):140-143.
[7] ROY S, CHIKKERUR J,로이 S, et 알다.Tagatose as a potential nutraceutical:production, properties, biological roles, and applications[J]. 「 metacion 」.한국식품과학회지, 2018, 83(11):2699-2709.
[8] 아라이 라크스미 F S, 아라카와 T 등.from L-arabinoseisomerase의 발현 및 특성 산성 조건에서의 활성 향상을 위한 Geobacillus stearothermophilus [J.단백질 발현과 정화, 2020, 175:105692.
[9]. BOBER 주니어, 나일 누다. 갈 락 토 오 스 to tagatose isomerization at 적당 한 온도 with high conversion and 생산성다 [J다]Nature Communications, 2019, 10(1):4548.
[10] GUO Q,AN Y,YUN J 외.분리된 Lactobacillus brevis PC16과 biotransformation[J] 으로부터 포자 표면에 전시된 L-arabinose isomerase에 의한 D-tagatose 생산이 향상되었다.바이오원천기술, 2018, 247:940-946.
[11] 드수사 M, 멜로 V, 히사 D 등.D-tagatose 합성을 위한 재조합 Enterococcus faecium DBFIQ E36 L-arabinose isomerase의 1단계 고정화 및 안정화 (J.「 적용Biochemistry and Biotechnology 」, 2019, 188(2):310~325.
[12] 드SOUZA T,OLIVEIRA R,BEZERRA S 외.잔류 유당 유도에 의한 Enterococcus faecium DBFIQ E36 으로부터 L-arabinose isomerase의 대체 이형발현 [J].분자생명공학, 2021, 63(4):289-304.
[13] 다효소촉매시스템에 의한 말토덱스트린으로부터 d-타가토스의 생합성 (DAI Y.2021년 장난대학.
[14] 구오 q의 생산을 사용 하여 유당에서 D-tagatose β-galactosidase과 L-arabinose isomerase[D]다.산동대학, 2018.
[15] 이즈모리 K. Izumoring:a strategy for bioproduction of all hexoses[J].한국생명공학회지 2006, 124 (4):717-722.
[16] 류 Y,리 S, 수 H 등.식품급 표면표시 시스템을 이용한 d-타가토스의 효율적 생산 [J.한국농식품화학학회지, 2014, 62(28):6756-6762.
[17] 정 Z,시 J, 류 P 외.치즈 유장 분말로부터 d-타가토스와 바이오 에탄올의 이중 생산을 위한 우아하고 효율적인 바이오 변환 (J.한국농식품화학학회지 2019, 67(3):829-835.
[18] 왕 Z, 왕 M, LYU X 등.one-pot boronate 친화성 흡착제를 이용한 갈락토스로부터 고순도 타가토스의 재활용 준비-흡착 보조 이성질화 및 동시 정화 [J].화학공학회지, 2022, 446:137089.
[19] BORTONE N, FIDALEO M. 안정화 움직이의 L-arabinose isomerase for the production of D-tagatose from D-galactose다 [J다]Biotechnology Progress, 2020, 36(6):e3033.
[20] 데 수사 M, 실바 구르겔 B, 페셀라 B 외.d-타가토스 합성을 위한 재조합 L-아라비노스 이성질체 효소의 정제 및 자성 클리어스 (Preparation of CLEAs and magnetic CLEAs 한recombinant L-arabinose isomerasefor D-tagatose synthesis[J])효소와 미생물기술, 2020, 138:109566.
[21] 쳉 L, MU W, 장 T, et 알다. 한 L-arabinose isomerase from Acidothermus cellulolytics ATCC 43068: 복제, 표현, 정화, 특성화 [J.한국미생물학회지, Applied 미생물학and Biotechnology, 2010, 86(4):1089-1097.
[22] 김 J, 프라 부 P, JEYA M, et 알다. 성격 묘사 of an L-arabinose isomerase from Bacillus 항생제다 [J다] Applied Microbiology 그리고 생명공학, 2010, 85(6):1839-1847.
[23] RHIMI M, ILHAMMAMI R, BAJIC G, et al.의 산내성이 있는 L-arabinose 이성질체 식품 등급 유산균 sakei 23K는 매력적인 d-타가토스 생산업체 [J].바이오원천기술, 2010, 101(23):9171-9177.
[24] XU Z, QING Y, LI S, 외.Lactobacillus fermentum의 새로운 L-arabinose 이성질체 d-타가토스 생산을 위한 CGMCC2921:유전자 클로닝, 정제 및 특성 [J.한국분자촉매학회지 B:효소제, 2011, 70(1):1-7.
[25] 서태지 M. 성격 묘사 of an L-arabinose isomerase from Bacillus thermoglucosidasius for D-tagatose 생산 [J]이다. 「 생명공학 Biotechnology and Biochemistry 」, 2013, 77(2):385-388.
[26] 팬 C, 류 K, 장트 등.연구논문:Alicyclobacillus hesperidum URH17-3-68 (J)의 thermostable L-arabinose isomerase의 생화학적 특성 (생화 학적characteristics of thermoacidophilic bacteria, Alicyclobacillus hesperidum URH17-3-68)한국분자촉매 학회지 B:효소, 2014, 102:120-126.
[27] 메이 W,왕 L, 짱이 외.Bacillus coagulans NL01로부터 L-arabinose isomerase의 특성 및 d-tagatose 생산을 위한 응용 [J].BMC 생명공학, 2016, 16(1):55.
[28] XU W, 팬 C, 장 T, et al. 복제, expression, and 성격 묘사 of a 소설 L-arabinose isomerase from the 내습성 세균 Pseudoalteromonas haloplanktis[J.분자생명공학 (Molecular Biotechnology), 2016, 58(11):695-706.
[29] 우 옌 T, 홍콩 M, 장 씨는 P, et al. 생화 학적 속성 L-arabinose의 isomerase from 클 로스 hylemonae to produce D-기능성 감미료로서의 타가토스 [J.플로스원, 2018,13(4):e0196099.
[30] 두엠, 자오 D,청 S 외.부제:Towards efficient enzyme zymatic conversion of D-galactose to D-tagatose:purification and characteristics of L-arabinose isomerase from Lactobacillus brevis[J].바이오공정 및 바이오시스템공학 (Bioprocess and Biosystems Engineering), 2019, 42(1):107~116.
[31] MANZO R, ANTUNES 한, DE 수자 M, et al. Biochemical 성격 묘사 내열성 재조합 (heat-tolerant recombinant) L-arabinose isomerase Enterococcus faecium DBFIQ E36 균주로부터 d-타가토스 생산에 실현 가능한 [J.분자생명공학 (Molecular Biotechnology), 2019, 61(6):385-399.
[32] 장 G, 안 Y, 파르베즈 A 외.d-타가토스 생산을 위해 Bifidobacterium adolescentis 로부터 매우 d-갈락토스 특이적인 l-아라비노스 이성질체를 탐색하였다 [J].Frontiers in Bioengineering and Biotechnology, 2020, 8:377 쪽.
[33] SHIN K, SEO M, KIM S, 외.Klebsiella pneumoniae 로부터 L-arabinose isomerase의 특성 및 D-galactose 로부터 D-tagatose의 생산에 대한 응용 [J].응용과학, 2022, 12(9):4696.
[34] KIM H, HYUN E, KIM Y, et al.D-fructose를 D-psicose로 전환하는 Agrobacterium tumefaciens D-psicose 3-epimerase의 특성 (characteristics of an Agrobacterium tumefaciens D-psicose 3-epimerase that conversion D-fructose to D-psicose [J])응용환경미생물학 (Applied and Environmental Microbiology), 2006, 72(2):981~985.
[35] 요시하라 A, 코자카이 T, 신타니 T 외.D-allulose의 정제 및 특성 3-epimerase는 GRAS 미생물인 Arthrobacter globiformis M30 으로부터 유래되었다 [J.한국생물공학회 학술발표논문집 2017년, 제2017권 123(2):170-176.
[36]리 S, 천즈, 장 W 등.의 d-타가토스 3-에피머화 특성 Caballeronia fortuita 및 희귀 설탕 생산에 응용 [J.International Journal of Biological macromolecule, 2019년,138:536-545.
[37] 자그탭 S, 싱 R, 강 Y 등.Rhizobium legumenosarum 으로부터 galactitol 2-dehydrogenase의 Cloning과 특성 및 D-tagatose 생산에 대한 응용 (J.효소와 미생물기술, 2014, 58-59:44-51.
[38] 장 S, 구 T, 신 Y 등.대사공학적 Lactiplantibacillus plantarum을 이용한 유당으로부터 D-tagatose의 생명공학적 생산 (J.LWT-식품과학기술, 2021, 142:110995.
[39] RAI S, KAUR H, KAULDHAR B 등.유장 유당을 고부가 희귀당 D-tagatose로 직접 변환하기 위한 이중 효소 금속 하이브리드 결정:합성, 특성 및 지속 가능한 공정 [J].ACS Biomaterials Science and Engineering, 2020, 6(12):6661-6670.
[40] ZHANG G, ZABED H, YUN J 외.Lactobacillus plantarum[J] 으로부터 L-arabinose isomerase를 발현하는 대장균 균주를 가공하여 우유 유장 분말로부터 d-타가토스의 2단계 생합성.바이오원천기술, 2020, 305:123010.
[41] 장 G, 자베드 H, 안 Y, et al.유즙이 풍부한 유제품 폐기물의 순차적 전세포 및 발효기술을 이용한 D-tagatose, D-arabitol 및 galactitol 로의 생물촉매 전환 (J.바이오원천기술, 2022, 358:127422.
[42] 다이 Y,리 C, 정 L 외.재조합 대장균의 모듈러 경로 공학을 통해 maltodextrin 으로부터 d-타가토스의 생합성을 향상시켰다 [J].생명화학공학회지, 2022, 178:108303.
[43] 황 W, 무 W, 장 B. D-타가토스 (J)의 분리 및 정제에 관한 연구.식품발효산업, 2008, 34(06):168-171.
[44] SU Q, 리 H, ZHA X, et al. 시뮬레이션 연구 on separation of D-tagatose and D-galactose in 시뮬레이션 움직이는 침대다 [J다] 현대화학공업, 2014, 43(07):1379-1381+1385.
[45] 왕 D, WANG Y, LI Y, et al. 파악 the role of impurity sugars on the crystallization of D-tagatose 크리스탈: 실험 그리고 분자 역학 시뮬레이션 [J].식품화학, 2022, 397:133762.


 영어
영어 프랑스
프랑스 스페인
스페인 러시아
러시아 한국
한국 일본
일본




