D 타가토스의 준비 방법은 무엇인가요?
DTagatose is 한rare six-carbon ketose sugar 에서nature. Its physical properties 그리고sweetness are similar to sucrose. It has low energy content, can lower blood sugar, improve intestinal flora, 그리고prevent toothdecay. Foreign researchers have studied its physiological functions 그리고생산methods 에서more detail, 그리고D-tagatosehas been used as a low-calorie 감미료에서건강drinks, yogurt, fruit juice, 그리고foods 을diabetics in many countries. 에서2001, 이US음식and Drug Administration (FDA) 결정th에서it was generally recognized as 안전(GRAS) [1]. There has been little research on tagatose in China, and 이re are many problems 와its industrial production and its application also needs to be studied. However, 이number 의people with diabetes and cardiovascular diseases is increasing year 에 의해year in China, and 이demand 을functional sweeteners is also growing. Therefore, D-tagatosehas great market potential in China.
1 D-tagatose
1. 물리적, 화학적 성질 1
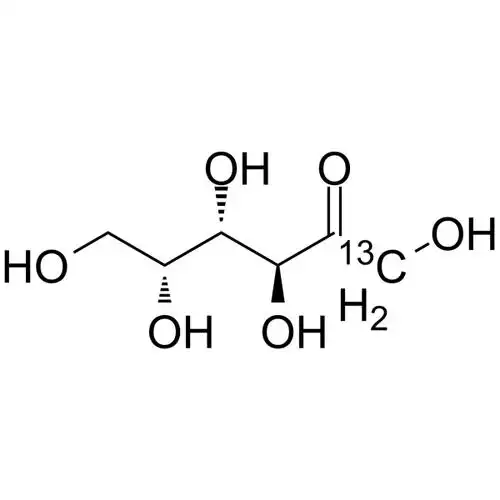
D-tagatose is an isomer 의D-galactose and a diastereoisomer 의D-fructose (see Figure 1), with a relative molecular mass 의180.16 u. Pure D-tagatose is a white, odorless, non-crystalline substance with a melting point 의134 °C. It is stable in the pHrange 의2 to 7. It is highly soluble in water, with a solubility 의58% at 21°C. Its hygroscopicity is similar to that 의sorbitol, and its viscosity of 180 cP (70% (w/w), 20°C) is lower than that of sucrose, slightly higher than that of sorbitol and fructose [2]. 이sweetness is similar to that of sucrose, with a sweetness level of 92% of sucrose, and the calories produced are only 1/3 of sucrose. The U.S. FD한has confirmed it as a low-calorie sweetener with an energy value of 1.5 kcal/g (approximately 6280.2 J/g). In addition, D-tagatose is prone to the Maillard reaction and can caramelize at lower temperatures.
1. 2 생리적 기능
(1) With low energy content, D-tagatose can be catabolized via the tagatose-6-phosphate pathway, which is present in some microorganisms but not in higher animals [3]. The absorption 속도of D-tagatose in the small intestine is very low. The part that is not absorbed 에 의해the small intestine reaches the large intestine and is completely fermented 에 의해the intestinal microorganisms, producing a large amount of short-chain fatty acids that are almost completely absorbed and metabolized. The fermentation process produces relatively low amounts of energy, and there is also a loss of energy due to the increased excretion of microbial waste products. Therefore, the energy produced by the catabolism of tagatose is much lower than that of sucrose. If tagatose is used to replace sucrose in the diet, it can effectively reduce the incidence of obesity.
(2) 혈당 저하:연구에 따르면 타가토스를 섭취한 후 혈당이나 인슐린 수치에 큰 변화가 없는 것으로 나타났습니다.또한 타가토스는 소장에서 포도당의 흡수를 억제하여 당뇨병 환자의 포도당 섭취로 인한 혈당 상승을 효과적으로 감소시킬 수 있으며, 제2 형 당뇨병 환자의 보조 요법의 역할을 한다.
(3) 장내 식물체를 개선한다.d-타가토스는 일부 미생물군에 의해 대장에서 선택적으로 발효되어 유익균의 성장을 촉진한다.그것은 좋은 프리바이오틱이다.동시에 d-타가토스의 발효로 생성되는 다량의 유익한 단사슬지방산은 대장암 억제, 장내 병원성 세균 억제, 유익균 증식 촉진 [3]에 좋은 효과가 있다.따라서 d-타가토스는 장내 식물체를 개선하고 장 건강을 유지할 수 있다.
(4) Anti-caries: D-tagatose is similar to polyols in protecting teeth다.입안에서 낮은 수준의 산을 생성하고 플라크의 pH를 낮추지 않기 때문에 카리에스와 법랑질의 침식 [4] 발생을 효과적으로 막을 수 있다.
2 d-타가토스 생합성
D-Tagatosecan be produced by bioconversion or chemical synthesis. Because chemical production of D-Tagatose is prone to the formation of impurities such as fructose, sorbitol and mannose, which require repeated crystallization to remove, this significantly reduces the yield of D-Tagatose. Therefore, bioconversion is being continuously researched as a better method.
타가토스를 생산하는 생물 전환 방법은 주로 d-갈락토스의 d-타가토스로의 전환을 촉매하기 위해 l-아라비노스 이성질체를 사용한다.L-arabinoseisomerase(EC 5.3.1.4, L-arabinoseisomerase, L-AI)의 자연적인 기능은 알도스와 케토스의 상호 전환 [5] 사이의 전환을 촉매하는 것이다.연구에 따르면 d-갈락토스를 d-타가토스로 전환하는 촉매도 할 수 있지만, d-갈락토스에 대한 친화도는 l-아라비노스에 대한 친화도보다 낮다.
2.1 L-AI 출원
L-AI의 최적 반응 조건은 원료에 따라 다릅니다.mesophilic bacteria 로부터 L-AI에 대한 최적 반응온도는 30 내지 50 °C로 Alicyclobacillus acidocaldarius, Bacillus halodurans, Escherichia coli, 유산균gayon-ii 등이 있다.열중성자균으로부터 L-AI에 대한 최적 반응온도는 60 ∼ 80 °C로 Geobacillusstearothermophilus, G. thermodenitrificans, Thermoanaerobacter mathrani 등이 있다.hyperthermophilic bacteria 로부터 L-AI에 대한 최적 반응온도는 thermo-toga neapolitana와 T. Maritima를 포함하여 85-90°C이다.온도가 증가함에 따라 L-AI의 D-tagatose 로의 전환율이 증가하므로, 이전의 L-AI 원천은 대장균 stearothermophilusUS100, Thermoanaerobacter mathrani와 같은 열성세균이 대부분이었다.그러나 이런 열성세균은 식품급미생물이 아니며 식품안전성도 의심스럽다.따라서, 연구원들은 d-타가토스를 생산하기 위해 식품 등급의 미생물을 사용하기 시작했다.
인류는 수천 년 동안 젖산균을 이용해 각종 유제품과 같은 발효식품을 만들어 왔다.락토코커스 락티스 (Lactococcuslactis)는 현재 일반적으로 안전한 (GRAS) 유기체로 인식되는 최고의 유기체 중 하나이며, 많은 다양한 단백질 제품에 효과적인 발현 숙주이기도하다.게다가 젖산균이 성장하는 pH는 젖당이 가수분해되는 pH와 같기 때문에 d-타가토스의 생물 전환에 탁월한 선택이다.현재 l-타가토스를 발현하는 것으로 밝혀진 식품급 유산균 균주는 Lactobacillus gayon-ii [6], Lactobacillus plantarum[7], Lactobacillus sakei 23K [8], 2011년에 발견된 [9].Lactobacillus fermentum 등이 있다.(Lactobacillus sakei 23K) [8]와 2011년에 발견된 식품급 균주인 Lactobacillus fermentum [9].식품 등급의 균주를 사용하면 타가토스의 미생물 효소 생산이 더 안전해집니다.
2. L-AI의 분자 변형 2
많은 종에서 ara한유전자 (L-AI 단백질을 발현하는) 가 확인되었지만 L-AI의 산업적 생산에는 여전히 많은 문제점이 있다.따라서 L-AI를 분자변형하여 산업생산조건에 맞는 효소를 얻는 것이 L-AI 연구의 중요한 부분이 되었다.대장균 L-AI의 결정구조가 규명되어 갈락토스를 타가토스에 이성질화하는 역할을 하는 분자를 규명할 수 있는 근거가 되었다.Rhimi등 (10)은 G. stearoothermophilus US100 으로부터 결정구조와 염기서열을 기반으로 L-arabinose이성질체의 필수 촉매 및 기층 인식 부위를 결정하였다.d-갈락토스의 전환율을 향상시키기 위해, L-AI의 분자 변형은 주로 기질 특이성, 내열성 향상, 최적 pH[11]저감 등에 초점을 맞추고 있다.
L-AI 유전자의 직접 진화는 반응 속도를 향상시키는 가장 효과적인 방법으로 간주되었다 [12].연구진은 중합효소 연쇄반응을 통해 G. stearothermophilus로부터 돌연변이 L-AI를 얻었다.효소는 야생효소인 V322M, A393T, A408V에 비해 3개의 아미노산 부위 변화를 보였다.이러한 L-AI 변형은 d-갈락토스에 대한 촉매 활성, 최적 온도, 촉매 효율 및 d-타가토스의 수율을 향상시켰다 [13].오덕균 연구단은 G. thermodenitrificans로부터 L-AI에 대한 site-directed mutagenesis를 수행하여 두 개의 돌연변이 부위 (C450S-N475K)를 갖는 효소를 얻었다.G. thermodenitrificans 로부터 AI를 site-directed mutagenesis 하여 이중 돌연변이 효소 (C450S-N475K)를 얻었다.이 이중 돌연변이 효소는 d-타가토스의 수율이 58% 인데 비해, 야생형 효소는 46%였다 [14].
연구에 따르면 Mn2 + 및/또는 Co2 +는 많은 L-AI의 활성과 열 안정성에 필요합니다.그러나 생물학적 효소법에 의한 d-타가토스 생산에서는 고농도의 금속이온을 첨가할 경우 후처리 비용도 증가하게 된다.따라서 열적 안정성을 갖는 금속이온 독립 L-AI에 대한 탐구는 L-AI 분자개질의 주요한 방향이 되기도 하였다.현재, 대장균 L-AI의 3차원 구조가 규명되었으며, 그것의 결정 구조와 대장균 L-trehalose 이성질체의 결정 구조를 비교하여 가능한 금속 결합 부위를 추측하고 있다 [15].
d-타가토스의 산업적 생산은 L-AI 가 산성 pH범위에서 반응해야 한다.d-타가토스는 pH2~7에서 안정하기 때문에 산성 상태는 갈변 반응을 줄일 수 있다.더욱이 생산시 유당은 보통 원료로 사용되며, 유당은 먼저 갈락토스로 가수분해되어야하고, 유당 가수분해가 보통 산성 조건 (pH5~6)에서 일어나므로 d-타가토스를 생산하기 위해 산성 L-AI 전환을 이용하면 pH 조정의 필요성을 없애고 비용을 절감할 수 있다.획득한 내산성 L-AI는 GSAI (pHopt 8.5) site-directed mutation [16]에서 얻은 Q408V와 R408V (pHopt 7.5)의 두 돌연변이를 포함한다.현재 pHopt에 영향을 미치는 아미노산 부위는 Val408 (GSAI) 및 Lys269 (AAAI, BHAI의 Glu268 및 BSAI의 Gln268에 대응)를 포함하여 결정할 수 있습니다.앞으로이 두 부위는 돌연변이가 되거나 L-AI의 결정구조를 바탕으로 pHopt에 영향을 미치는 다른 아미노산 부위를 찾을 수 있다.
2. L-AI의 3 식
현재 대장균은 숙주세포로 L-AI를 생산하는 경우가 많다.그러나 대장균의 내독소 생산은 안전성에 문제가 될 수 있다.따라서 산업 생산 및 응용에 적합한 L-AI 유전자를 얻은 후, 이를 식품급 유전자 조작 박테리아에 발현시키는 것이 새로운 연구 대상이 되고 있다.수 (Xu)등은 L-AI의 발현벡터로 Escherichia coli 대신 Lactobacillus fermentum CGMCC2921을 사용하였고 L-AI의 대규모 발현에 성공하였다.Noora et al. [18]은 L-AI 유전자를 젖산균인 Lactococcus lactis에 전달하여 인산염 열화 유도 발현 시스템에서 L-AI의 발현을 가능하게 하였다.
2. 고정화 생체 촉매를 이용한 d-타가토스의 생산 4
l-아이 발현이 높은 조작세균을 얻은 후, 효소나 효소를 생산하는 세포를 고정화시켜 효소의 기계적 강도를 향상시키고 효소 활성의 손실을 감소시켜야 한다.한국 서울대학교 오연구그룹은 실리카겔 흡착, 마이크로캡슐화, sodium alginate embedding, glutaraldehyde 교차연결 등의 다양한 고정화 방법을 이용하여 Escherichia coli L-AI를 고정화하고 다양한 고정화 방법이 D-tagatose의 전환율에 미치는 영향을 비교하였다.그 결과 알긴산-염화칼슘나트륨법을 이용하여 고정화된 비드를 얻은 후 글루타알데히드와 교반시켜 얻은 효소제제가 가장 좋은 효과를 보였다.
자유 효소, 고정화 효소, 고정화 세포의 d-타가토스 생성 능력을 비교해 본 결과, 같은 양의 세포를 사용했을 때, 고정화 세포에서 생성되는 d-타가토스의 수율이 가장 높다는 것을 발견하였다.게다가 L-AI를 생성하는 세포를 촉매로 사용하면 효소를 더 잘 보호하고, 효소의 변성을 방지하고, 반응 배치의 수를 늘리고, 전환 용액의 불순물을 줄일 수 있습니다.푸펑젠 등은 고정화 재조합 대장균 세포가 d-타가토스를 생산하는 능력을 연구했다.그 결과 24시간 동안 최적의 반응조건에서 d-타가토스를 기질로 사용한 결과, 최대 65.8%의 d-타가토스의 가장 높은 전환율과 8회 연속 배치시 평균 60.6%의 전환율을 고정화하여 d-타가토스의 산업적 생산을 위한 토대를 마련하였다.
d-타가토스의 수율에 미치는 붕산의 효과 2.5
반응 온도를 높이는 것 외에 반응 평형을 d-타가토스 쪽으로 이동시키는 또 다른 방법은 반응 혼합물에 붕산 [B(OH)4-]을 첨가하는 것이다.붕산은 당이 서로 다른 복잡한 복합체를 형성하며, 일반적으로 알도스보다 케토세스에 더 큰 친화력을 보인다.이 특성은 예를 들어 탄수화물의 크로마토그래피 분리에서 알도스로부터 케토스 형성을 향상시키기 위해 이용되었다.붕산염은 케토스와 더 단단한 복합체를 형성하는데, 예를 들어 d-갈락토스보다 d-타가토스와, l-리불로스와, d-프럭토스보다 d-알룰로스와 더 쉽게 결합한다.보레이트 버퍼가 존재하면 전환량이 증가할 뿐만 아니라 반응속도도 증가할 수 있다.
d-타가토스, l-리불로스 및-d-알룰로스는 붕산 존재시 각각 74, 89 및 64%의 최대 전환율을 갖는 것으로 보고되었다.케토스 생산과정에 붕산을 첨가하면 원래의 화학평형을 깨뜨릴수 있고 목표제품의 수율을 높일수 있다.변환용액 중의 붕산은 특수한 붕산 이온 교환 컬럼 [20]을 이용하여 탄수화물-붕산 복합체에서 제거되며, 생성물의 순도에는 영향을 주지 않는다.Noora 등 [18]에 의하면 60°C, pH 9.0에서 Thermotoga neapolitana에서 추출한 L-AI를 이용하여 d-타가토스의 수율을 74%로 나타내었으며, 붕산을 첨가하였을 경우 붕산을 첨가하지 않은 대조군보다 24% 높은 수율을 나타내었다.푸펑젠 등은 고정화된 재조합 대장균 세포에 의한 d-타가토스의 생산에 관한 연구에서 이성질화 반응 시스템에서 기질에 대한 붕산의 몰비가 수율에 미치는 영향을 조사하였다.그 결과 적절한 양의 붕산을 첨가하면 원래의 화학 평형을 변화시키고 d-타가토스의 높은 수율을 얻을 수 있음을 알 수 있었다.
2. d-타가토스의 분리 및 정제6
Both the bioconversion and chemical conversion methods use D-galactose as the raw material, and the final reaction product is a mixture of D-tagatose and D-galactose. Therefore, the separation and purification of D-tagatose is also a factor affecting the yield of D-tagatose.
일반적으로 사용되는 분리방법에는 케이션 교환 크로마토그래피 또는 단순 수지 분리 등이 있다.황원하 등 21명은 Ca2 + 이온교환수지 크로마토그래피와 음이온 및 케이션교환수지 담수 및 탈색을 이용하여 d-타가토스를 분리 및 정제하였다.d-타가토스의 회수율은 83%에 달했고, 순도는 98에 달했다.분리의 원리는 주로 Ca2 +로 여러 단당류의 착색도의 차이에 따라 단당류를 분리하고 정제한다.또한 D-tagatose는 맥주 효모세포 (Saccharomyces cerevisiae L1)를 이용하여 선택적으로 D-galactose를 분해함으로써 정제될 수 있다는 것이 문헌에 보고되었다.이 방법으로 얻은 d-타가토스의 순도는 95% 이상에 도달 할 수 있습니다.미반응 d-갈락토스는 재사용을 위해 회수할 수 없지만,이 방법은 분리 효율이 높고 비용이 저렴하며 조작이 간단하여 d-타가토스의 산업 생산에 더 많은 옵션을 제공하는 장점이 있다.
3. d-타가토스의 응용
3.1. 식품에의 응용 Applications in food
Because D-tagatose has physical properties and sweetness similar to sucrose, and also has physical and chemical properties such as 산resistance, alkali resistance and heat resistance, it has broad application prospects in the food industry as a functional sweetener. It can be used in healthy drinks, yogurt, chocolate, chewing gum, foods for diabetics, diet foods, cereal foods, etc.
현재 음료 산업에서 일반적으로 사용되는 주요 감미료는 사이클라메이트, 아스파탐, 사카린, 아세설팜, 스테비아 등이다.이것들은 모두 금속성, 쓰고 떫은 풍미와 같은 바람직하지 않은 뒷맛을 내기 쉬운 강한 감미료입니다.그러나 타가토스를 첨가한다고 해서 바람직하지 않은 뒷맛이 나는 것은 아니다.또한, d-타가토스는 유산균 카세이 (Lactobacillus casei)와 락토바실러스 람노서스 (Lactobacillus rhamnosus)와 같은 유산균의 성장을 촉진하며, 프로바이오틱스를 발효시켜 활용할 수 있는 좋은 프리바이오틱스다.

Studies have shown that D-tagatose can promote the growth of Lactobacillus casei and Lactobacillus rhamnosus, improve their beneficial activity and survival rate in the intestine. Therefore, D-tagatose can be used in probiotic supplements and also in yogurt, where it provides sweetness while increasing the number of live bacteria in the yogurt, enhancing its nutritional value and giving it a richer, fuller flavor. In 2001, the US Food and Drug Administration officially approved the use of D-tagatose as a sweetener in the food and beverage industry. In 2003, PepsiCo began using tagatose in Sprite drinks, and since then it has been widely used in the United States as a substitute for sucrose in healthy drinks, yogurt, fruit juice and other products.
D타가토스는 낮은 온도에서 캐러멜화 되기 쉬운 특징을 가지고 있다.연구에 따르면 d-타가토스는 아미노산과 마이야르 반응을 거쳐 포도당이나 갈락토스와 같은 당을 환원시키는 것보다 2-아세틸퓨란, 2-에틸피라진, 2-아세틸티아졸 등의 휘발성 물질을 생성한다 [22].그것은 이상적인 색을 낼 뿐만 아니라 더 부드러운 맛을 내기 위해 구운 음식에 사용됩니다.타가토스는 자크로스보다 점도가 낮고 쉽게 결정화되기 때문에 아이싱을 만드는 데 사용해 시리얼 식품 표면에 바르면 제품의 단맛을 높이고 유통기한을 연장할 수 있다.
3. 2 의학, 화장품 및 기타 분야에 응용 프로그램
d-타가토스는 제2 형 당뇨병 치료제로 약에서 사용될 수 있다.연구에 따르면 d-타가토스는 체중을 줄이고 고밀도지단백 (HLP)의 함량을 높여 제2 형 당뇨병의 증상을 줄일 수 있는 것으로 나타났다.또한 기침약, 틀니 접착제 및 구강 소독제에 사용될 수 있습니다.d-타가토스는 화장품에 안정제와 보습제로 사용된다.d-타가토스는 충치와 구취에 효과가 있기 때문에 치약이나 구강청결제 등에 사용할 수 있다.현재 많은 치약들이 d-소르비톨이나 글리세린, 혹은 둘다 체액제로 사용하고 있다.그러나 d-소르비톨은 수크로스의 절반밖에 달지 않지만, d-타가토스는 수크로스와 마찬가지로 단맛이 강하고 소르비톨과 흡습성이 비슷하다.치약이나 구강청결제 등에 d-타가토스를 첨가하면 단맛을 강화하고 흡습성과 안정성을 유지하면서 미각 요건을 충족시킬 수 있다.
참조
[1] 레빈 G V.타가토스, a 새로 운 그 라스 sweetener and health 제품 [J.J 의대 식품,2002,5:23-36.
[2] Oh D K. Tagatose: propertiea, 응용 프로그램 and biotechnological 프로세스 [부연설명]'J.한 기초 Microbiol Biotechnol,2007,76:1-8.
[3] 무완맹, 장타오, 장보 등.D -타가토스와 l-아라비노스 이성질체 효소 연구 진행 [J.식품 및 발효산업, 2007, 33:84-90.
[4] 웡 D. 감미료 determined safe in 약, 구강청결제, 치약 [부연설명]'J.덴트 투데이,2000,19:32,34-35.
[5] 량민, 자이야페이, 조우양 외.새로운 감미료 타가토스 [J]의 응용 및 생산.식품의약품안전처, 2011, 13:125-128.
[6] 치담 P S, 우튼 한 N.Bioconversion D의 -갈 락 토 오 스 로 D-tagatose [부연설명]'J.효소 Microb Technol,1993,15:105-108.
[7] 추아예 k h H, Bejar W, Rhimi (영어) M, et 알다. 성격 묘사 of ㄱ 아라비노스 isomerase 에서 the Lactobacillus plantarum NC 8 strain 보여주는 발음 안정 at 산성 pH [부연설명]'J. FEMS Microbiol Lett,2007,277:260-267.
[8] Rhimi M, 일함마미 R, 바직 G, et 알다. The acid 관대 한 L arabinose isomerase는 식품등급 유산균 sakei 23 K 가 매력적입니다 D-tagatose 프로듀서 [부연설명]'J. Bioresour 테크노놀, 2010, 101:9171-9177.
[9] Xu Z, 칭 Y J,리 S, et 알다. A 소설 L-arabinose isomerase Lactobacillus fermentum에서 유래 CGMCC2921 for D-tagatose 생산:유전자 복제, 정제 및 특성 [부연설명]'J.JMol 카탈 B:엔자임,2011,70:1-7.
[10] Rhimi M, Juy M, Aghajari (아하자리) N, 외.조사를 필수 촉매 잔류물 and the 기질 친밀감이 in the thermoactive Bacillus stearothermophilus US100 L-arabinose isomerase by site-directed mutagenesis) [J.J 박테리올 2007,189:3556-3563.
[11] 김 P.현재 연구 L-arabinose isomerase를 이용한 생물학적 tagatose 생산에 관하여:a 검토 and 미래 관점 [부연설명]'J. 한 기초Microbiol Biotechnol,2004,65:243-249.
[12] 김 P, 윤 S H, 서태지 M J, et 알다. 개선 of tagatose 변환 rate by 유전 진화 of thermostable 갈 락 토 오 isomerase [부연설명]'J.Biotechnol 한 기초 생화학2001,34:99-102.
[13] 김 H J, 김 J 아, 오 H J, 외.성격 묘사 of a 돌연변이 Geobacillus stearothermophilus L-arabinose isomerase 그것은 d-타가토스의 생산 속도를 증가시킵니다 [부연설명]'J.J Appl 마이크로바이올, 2006,101:213-221.
[14] 오 H J, 김 H J, 오 D K.site-directed에 의한 d-타가토스 생산율 증가 mutagenesis의 L-arabinose isomerase Geobacillus에서 thermodenitrificans [부연설명]'J. Biotechnol Lett 한국보건사회연구원, 2006, 28:145-149.
[15] 오 D K. 타가토스:속성, 응용, 그리고 biotechnological 프로세스 [부연설명]'J.한 기초 Microbiotechnol,2007,76:1-8.
[16] 오 D K, Oh H J, Kim H J 외.L arabinose에서 최적 pH의 수정 (Modification of 최적 pH in L arabinose isomerase 에서 Geobacillus stearothermophilus for d-갈락토스 이성질화 [부연설명]'J.J Mol Catal 2006년 B-Enzym, 43:108 -112.
[17] 수 Z,리 S, 푸 F, et 알다. 생산 of d-타가토스, a Alginate ImmobilizedLactobacillus fermentumCGMCC2921Cells를 이용하는 기능성 감미료 [부연설명]'J. Appl Biochem Biotechnol, 2012,166:961-973.
[18]. Noora S, 칼레 S, 마티 L, et 알다. D-Tagatose production in the
보레이트 (borate)의 존재 by 휴식 Lactococcus lactis 세포 비호 Bifidobacterium longum L-arabinose isomerase [부연설명]'J. 생물공정 Biosyst Eng,2013,36:499-497.
[19] 푸펑젠, 서정, 리기샹 등.고정화 재조합 대장균 세포를 이용한 d-타가토스의 생산 [J.중국생명공학저널, 2011, 31:85-90.
[20] 힉스 K B, 심슨 G L, 브래드버리 A G. 제거 of 일컫는 산과 관련 화합물 에서 솔루션 of carbohy-drates with 붕소-선택적 수지 (IRA-743) [부연설명]'J. Carbohydr Res,1986, 147:39-48.
[21] 황원하, 무완맹, 장보.d-타가토스 [J]의 분리 및 정제.식품발효산업, 2008, 34:168-171.
[22] In H D, 사라 L, 해-라운그 J, et 알다. 비교 of 불안 정한 Maillard 반응 제품 에서 Tagatose and 다른 설탕을 줄이 with 아미노산 산 [부연설명]'J. Food Sci. Biotechnol,2010, 19:431-438.


 영어
영어 프랑스
프랑스 스페인
스페인 러시아
러시아 한국
한국 일본
일본




