The Power of Fermented CoQ10 Ingredient: Empowering Advanced Health Supplements
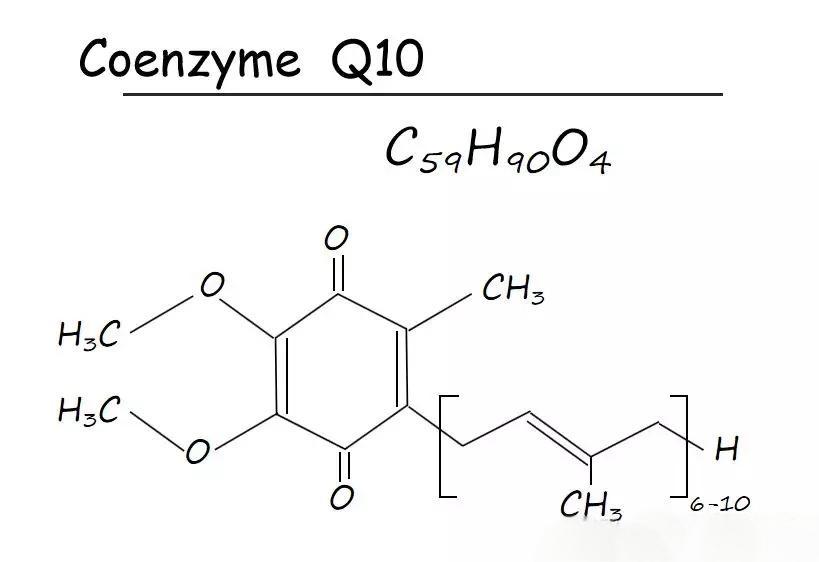
In the increasingly mature health supplement market, consumers are becoming more discerning than ever. They no longer settle for products that merely “contain” certain ingredients, but now demand to know “in what form?” For the core ingredient Coenzyme Q10, the answer is clear: chemically synthesized ‘cis’ structures are being phased out due to their low potency, while the natural “all-trans” form has become the gold standard for premium products. This heightened awareness presents unprecedented market opportunities for brands focused on product excellence.
Facing this trend, the core challenge for brands lies in: how to consistently secure high-quality natural-form CoQ10 raw materials? Green Spring Technology deeply understands your predicament. We are committed to becoming your reliable strategic partner, leveraging our proprietary advanced microbial fermentation technology to break through your raw material bottlenecks, allowing you to focus on brand building and market expansion.
What can we offer you?
★ Provide a “Foundation of Trust” to lower consumer decision barriers
When your product clearly states “Derived from natural microbial fermentation” and specifies “All-trans structure, high bioavailability,” you present consumers with a clear, credible reason to choose your premium option. This goes beyond mere ingredient labeling—it becomes a powerful marketing tool that effectively boosts conversion rates and customer loyalty.
★ Build a “Differentiated Advantage” to Stand Out from Homogeneous Competition
Amidst countless products using chemically synthesized CoQ10, your brand will rapidly distinguish itself with the distinctive label “Naturally Fermented CoQ10,” securing a commanding position in the category. This represents not just an ingredient upgrade, but a comprehensive elevation of your brand image.
★ Ensuring “Supply Chain Security” for Sustainable Growth
Supply chains reliant on imports and animal/plant extraction face significant uncertainties. Green Spring Technology's localized, stable supply provides reliable, traceable, and sustainable raw material assurance, freeing your product planning and marketing efforts from supply chain concerns.
1 Empowering the Next Generation of Health Supplements: Why Choose Microbial Fermentation Coenzyme Q10?
today&에서#39;s era of precision nutrition, the origin and production process of CoQ10 raw materials directly determine the efficacy and quality of end products. As your ingredient partner, we specialize in advanced microbial fermentation technology to provide you with highly active, pure natural CoQ10, injecting powerful competitiveness into your health supplements.
1.1 Why Is Microbial Fermentation the Preferred Source for Premium Supplements?
Coenzyme Q10 is primarily produced through chemical synthesis, animal/plant extraction, or microbial fermentation. Compared to the first two methods, microbial fermentation represents a more advanced and reliable technological approach:
1.1.1 Chemical Synthesis
Produces unnatural “cis” structures with low bioactivity and potential chemical residues, increasingly phased out in premium markets.
1.1.2 Animal/Plant Extraction
Severely constrained by raw material availability, yields extremely low quantities (e.g., only ~75mg per kg of pig heart), and offers unstable sources, making it unsuitable for large-scale production.
1.1.3 Microbial Fermentation Method (Our Process):
★ Natural Structure & High Bioavailability
Fermentation yields a natural “trans” structure homologous to the human body, offering exceptional biological activity and superior absorption for guaranteed supplementation efficacy.
★ Purity & Safety
Entirely free of animal-derived components and chemical solvent residues, aligning with clean label trends and meeting consumers' highest demands for purity and safety.
★ Sustainable and Stable Supply
Unaffected by fluctuations in animal/plant raw material availability, our controlled fermentation process enables consistent, large-scale supply to safeguard your production plans.
1.2 Empowering You with Cutting-Edge Fermentation Technology
We understand traditional fermentation methods were constrained by efficiency and cost. Through proprietary strain selection and fermentation process optimization, we've overcome these limitations to achieve high-content, high-efficiency industrial production. This enables us to provide you with a stable supply of high-quality CoQ10 raw materials solution while helping you effectively control costs.
By choosing our fermented CoQ10 raw materials, your brand gains three core advantages:
▲ Exceptional Product Efficacy
The “natural trans” structure ensures your products deliver outstanding bioactivity, providing consumers with tangible health benefits.
▲ Powerful Market Selling Points
Labels like “naturally fermented,” “high bioavailability,” and “pure with no residues” will make your products stand out in the competitive market.
▲ Stable and Reliable Supply Chain
Break free from dependence on animal or plant-based raw materials and gain access to a sustainable, scalable, and stable supply of raw materials.
Let's work together to create the next generation of market-leading health supplements with more natural and efficient CoQ10 raw materials.
2 Core Technological Advantages: Derived from Superior Strains and Precision Fermentation Processes
To deliver industry-leading fermented CoQ10 raw materials, we focus on the source. We have built core strengths in high-yield strain selection and precision fermentation processes, ensuring a solid foundation for high-performance products from the cellular level.
2.1 Selecting Natural Strains to Establish High-Content Foundations
We understand that raw material efficacy begins with the microbial strain. In nature, photosynthetic bacteria (particularly the Rhodospirillaceae family) have been proven to be “natural high-yield factories” for CoQ10, with natural concentrations far exceeding other strains. For example:
· Rhodospirillum rubrum contains up to 6.3 mg/g
· Rhodopseudomonas palustris (Rp. palustris) contains up to 4.5 mg/g
Building on this scientific consensus, we have screened and engineered production strains centered on high-yielding Rhodopseudomonas species. This ensures that every batch of raw material you receive contains high concentrations of natural CoQ10 from the source.
2.2 Cutting-Edge Strain Modification: Continuously Pushing Yield Limits
Wild strains cannot meet industrial demands. We employ multi-target metabolic engineering and genetic engineering techniques to precisely optimize production strains, aiming to continuously enhance yield and purity:
◆ Metabolic Regulation Breeding
Through directed selection, we block competitive metabolic pathways like carotenoid synthesis, redirecting more precursors toward CoQ10 production, significantly boosting target product concentration.
◆ Construction of High-Efficiency Engineered Strains
We successfully cloned and enhanced key enzyme genes in CoQ10 biosynthesis, resolving rate-limiting steps in the pathway to establish stable, high-yielding proprietary engineered strains.
The application of these cutting-edge biotechnologies enables us to reliably supply higher-purity raw materials at optimized costs, directly empowering your products' market competitiveness.

2.3 Precision Fermentation Control Maximizes Product Synthesis Activation
With high-yielding strains in hand, precise fermentation control is essential to unlock their full potential. We simulated and optimized the optimal production environment for the strains:
2.3.1 Precise Nutrient Supply
By optimizing the medium formulation and adding specific metal ions (e.g., Mg²⁺, Fe²⁺) and natural precursors, we effectively promote bacterial growth and stimulate efficient CoQ10 synthesis.
2.3.2 Customized Environmental Regulation
■ Oxygen-Limited Cultivation
Research indicates that precisely controlling dissolved oxygen and redox potential significantly stimulates the development of inner membrane structures within photosynthetic bacteria—the very “cellular factories” responsible for massive CoQ10 synthesis—thereby substantially increasing intracellular content.
■ Light-Induced Cultivation
For specific strains, we employ light-induced anaerobic cultivation—conditions closest to their natural high-yield state—maximizing activation of the CoQ10 synthesis pathway.
2.4 Green Extraction Process, Preserving Natural Activity
During extraction, we utilize advanced non-saponification techniques or optimized acid-disruption direct saponification processes. This approach not only avoids potential structural damage to CoQ10 molecules inherent in traditional saponification methods but also preserves its natural trans configuration and biological activity. It is more environmentally friendly, cost-effective, and aligns with modern clean production standards.
Partner with us to gain:
● Source Advantage
High-yield strains validated by science, starting at a higher baseline.
● Technological Barriers
Continuous innovation capabilities rooted in metabolic engineering and precision fermentation.
● Quality Commitment
Green extraction processes guarantee the natural structure and high bioactivity of raw materials.
Let us co-create next-generation benchmark health supplements using premium ingredients meticulously cultivated from the cellular level.
The future of the CoQ10 market belongs to brands that pioneer access to efficient, natural, and stable raw material sources.
Green Spring Technology specializes in microbial fermentation technology. We provide not just CoQ10 raw materials, but a cost-competitive solution featuring high bioactivity and a fully trans natural structure. This solution directly empowers your products to stand out in the fiercely competitive market.
Contact us at helen@greenspringbio.com or WhatsApp: +86 13649243917 now to receive exclusive samples and product solutions. Let's collaborate to create the next market-disrupting star supplement using premium fermentation ingredients!
참조:
[1] 윈난 동물학 연구소. 사이토크롬 C[J] 제조를 위한 돼지 심장 잔류물로부터 코엔자임 Q10분리. 제약산업, 1976,(2):22.
[2] 우쥬팡 외. 코엔자임 Q10의 기능에 대해 진행합니다.[글/신화사 기자 닝보 (寧波), 번역/신화망 한국어판] 2001년, 14 (2):85-88.
[3] Yuan Yi. 돼지 심장으로부터 코엔자임 Q10 (CytC) 추출 및 정제 [J.안휘농업대학 1997, 24(2):200~203.
[4] Carr NG와 Exell G. ubiQuiNoNe 농도 iN Athio-rhodaCeae growth uNder Various eNViroNmeNtal CoNditioNs [J]. rhodaCeae는 다양한 환경 조건하에서 성장 [J.BioChim다.J., 1965, 96:688~692.
[5] 유비퀴논 [J]의 OlsoN EO와 RudNey H. 생합성.Vitam다.Horm다., 1983, 40:1~43.
[6] Yoshida H 등 bac-terial [J]을 이용한 유비퀴논-10 생산. J. 대장. Appl.MiCrobiol다., 1998, 44:19~26.
[7] 엘 하치미 Z, 사무엘 오 외.대장균에서 유비퀴논 바이오신서시스에 관한 생화학적 연구 1.para-hydrabenzoate polypreNyltraNsferase의 특이성 (J. 즉 BioChim-., 56:1239~1247.
[8] 쇼쿠힌 A. 유비퀴논의 형성-10.Jp11056372다.
-
Prev
마난올리고당 (Mannan Oligosaccharide) 이란?
-
다음
Green Spring Technology: Guaranteeing Your Supply of High-Bioavailability CoQ10 Powder


 영어
영어 프랑스
프랑스 스페인
스페인 러시아
러시아 한국
한국 일본
일본




