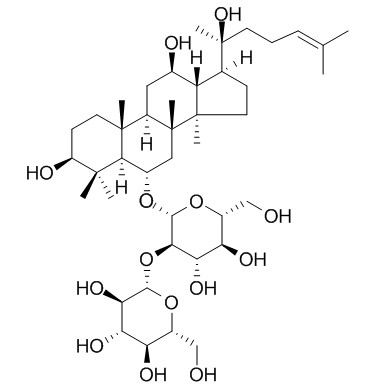
인삼 추출물 Ginsenoside의 종류에 따른 연구
Ginsenosides (GS) are 이ma에서활성ingredients 에서precious medicinal herbs such 로ginseng, panax notoginseng 그리고American ginseng. They belong to 이triterpenoid glycoside class 그리고are composed 의한glycoside (ginsenoside) 그리고a sugar group [1]. Ginsenosides have a wide range 의생물학적activities, such as anti-tumor[2], 항 염증[3], anti-fatigue [4-5] 그리고anti-oxidati에[6], etc., 그리고secondary ginsenosides exhibit even more excellent activities. However, the highly active secondary ginsenosides have problems such as low content, 가난 한water solubility, low bioavailability and short half-life [7], which limits the applicati에의ginsenosides in the fields 의food health care and biomedicine.
구조 개조는 진세노사이드 (ginsenosides)의 생물학적 활성을 향상시키고 약리성을 개선하며 독성을 감소시키는 중요한 수단이다.진세노사이드 (Ginsenosides)는 보통 1-4 친수성 당 모이어티에 연결된 소수성 아글리콘으로 구성되므로이 두 가지 방법으로 변형될 수 있습니다.현재 진세노사이드의 개질은 주로 화학적 개질 전략을 채택하고 있으며, 아글리콘 구조를 개조하거나 당사슬 [8]을 개조하여 더 나은 활성과 물리화학적 특성을 가진 진세노사이드 유도체를 얻는다.구조 면에서 아글리콘의 사이클로알케인 구조는 안정적이며, 아글리콘 근간을 직접 수정하기는 어렵다.
현재 주요 개질 전략은 아글리콘의 히드록시기 그룹에 초점을 맞추고 있으며, 에스테르화, 산화, 헤테로사이클의 도입 또는 분자 혼성 등의 합성 방법을 통해 다양한 구조를 가진 유도체가 얻어진다.설탕 사슬에 대한 수정은 주로 설탕 moiety의 연장 또는 설탕 사슬에 hydroxyl 그룹의 수정을 포함한다.연구에 따르면 ginsenoside 모핵에 있는 당군의 종류, 수 및 결합부위는 ginsenosides의 생물학적 활성과 밀접한 관련이 있다 [18-20].일반적으로 당 그룹의 수와 진세노사이드의 항암활성과의 관계는 다음과 같다:아글리콘>단당류 글리코사이드>이당류 글리코사이드>trisaccharide 글리코 사이드>tetrasaccharide glycoside다.따라서 ginsenosides의 당사슬을 수정하는 것은 그들의 생물학적 활성을 향상시키는데 매우 중요하다.본 논문은 최근 진세노사이드 (ginsenosides)의 화학적 변질 및 생물학적 활성에 대한 진전을 살펴보고, 구조-활성 관계를 해명하며, 진세노사이드 (ginsenosides)의 특성 및 구조 변질의 법칙을 요약하여 차후 구조 변질을 위한 참고자료를 제공한다.
진세노사이드 (ginsenosides)의 분류 및 구조적 특성 1
아글리콘의 다양한 구조에 따라 세 가지 유형으로 나눌 수 있습니다:dammarane 유형, oleanane 유형 및 ocotillol 유형.Dammarane-type ginsenosides는 아글리콘에 부착된 치환기의 위치에 따라 protopanaxdiol (PPD)과 propanaxatriol (PPT)로 더 세분화될 수 있다.
1.1 Dammarane 타입
Dammarane-type ginsenosides include PPD and protopanaxatriol (PPT), which are tricyclic triterpene saponins. Comm에protopanaxadiol ginsenosides include C-K (1), Rh2(2), Rd (3), Rg3 (4), Rb1 (5), Ra1, Ra2, Ra3, Rb2 and panaxadiol (PD) (Fig. 1). Since ginsenosides 1, 2, 4 and 5 have stronger biological activity, 그들의합성and modification have attracted much attention [9-11]. Common protopanaxatriol-type ginsenosides mainly include Rh1 (6), Rg1 (7), Rg2 (8), Re, Rf, F1, F3, F5 and glycosylated panaxatriol (PT) (see Figure 2), among which 6, 7 and 8 have been studied extensively [8, 12].
1.2 올레아놀산 종류
Oleanolic acid type ginsenosides는 pentacyclic triterpene saponins으로, oleanane type saponins(귀리) 가 C-3 및 C-28위치에서 당화하여 형성됩니다.일반적인 올레아놀릭산 형태의 진세노사이드에는 R3 (9), Ro (10), R4 (11) 등이 있으며 [13-14] (그림 3 참조).
1.3 Ocotillol 유형
Ocotillol typesapogenins (OTS)는 C-20 및 C-24 연계 설탕 모이티의 구성에 따라 (20S,24S), (20R,24R) 및 (20R,24S)의 4가지 형태를 형성할 수 있다.옥시트로페 유형의 흔하게 발견되는 진세노사이드에는 F11 (12), RT5 (13), RT2 (14) 등이 있다 [15-17] (그림 4 참조).
ginsenosides와 구조-활동 관계의 구조적 수정 2
2.1에스테르화 수정
진세노사이드는 수용성이 떨어지고 지방용해성이 낮아 생체이용성이 낮고 건강유지 및 치료효과가 비효율적이다.약물 분자의 이상적인 지방성은 생체 이용성과 임상 효능을 보장하기 위해 일정 범위 내에 있어야 한다 [8].약리학적 연구에 따르면 진세노사이드는 경구 투여 후 장내 식물체에 의해 가수분해되며, 가수분해로 생성된 대사산물은 정맥을 통해 간으로 흡수되어 지방산과 반응하여 지방산 에스테르 화합물을 형성한다 [21].이상의 연구를 통해 지방산과 연관된 진세노사이드 유도체가 세포 내 세포독성이 낮고, 거주시간이 길며,보다 지속적인 효과를 나타냄.반면, 세포막은 주로 지질로 구성되어 있기 때문에 지방 성 에스테르 유도체는 전반적인 막 투과도를 향상시킴으로써 바람직하지 않은 약물의 경구 흡수를 향상시킬 수 있습니다.이러한 연구결과는 ginsenosides의 수정에 대한 아이디어를 제공한다.유기산 (지방산, 방향족산, 무수물), 아미노산 및 무기산 (황산) 등의 산을 이용한 ginsenoside의 개량은 ginsenoside 유도체 연구에 중요한 전략이다.
2.1.1 유기산 개질
Liang et알다.reacted the hydroxyl group at the C-3 position 의ginsenoside Rh2 (20S-Rh2, 2) with two 6-maleimidocaproic acid and 11-maleimidoundecanoic acid 파생상품with hydrophilic functional groups and different carbon chain lengths to obtain the esterified 파생상품15 and 16 (see Figure 5). Compared with Rh2, the solubility 의two modified products increased 에 의해about 4 times and 2 times, respectively. In vitro anti-proliferation 활동tests showed that compound 15, which has a shorter carbon chain, exhibited higher 억제activity against the HeLa cell line, while compound 16, which has a longer carbon chain, did not show anti-proliferative activity [22]. Li et알다.reacted decanoic acid, cyclohexanecarboxylic acid and isobutyric acid reacted with the C-20 hydroxyl group 의ginsenoside C-K to synthesize three ginsenoside C-K monoesterified derivatives (17–19) [23] (see Figure 5).
측면에서 유방암 세포의 성장 억제 선 MCF-7,의 억제 활동이 화합물에서 18과 19을 25 μ mol/L)보다 상당히 높은 것으로나 타 났 ginsenoside C-K,반면 복합 17 어떤 억제 효과 나타나지 않았다, ginsenoside 나타내는 파생상품 short-chain 지방산을 갖고 있는 수정 들보다 더 강력 한 anti-tumor 활동 사슬 지방산과 수정 됩니다.다른 연구 [24-27] 에서도 수정된 것으로 나타났다short-chain fatty acid saponin derivatives not only have optimized physicochemical properties, but also have better anti-tumor 효과than long-chain fatty acid esters.
Li 등은 글루코스 기반의 C-6 hydroxyl group을 제외한 [28] ginsenoside C-K의 완전 아세틸화 유도체를 합성하였으며 (그림 5 참조), 항암 활성 시험 결과 C-K와 비교하여 더 낮은 농도에서 다수의 종양 세포주의 증식을 억제하면서도 주요 장기에 대한 부작용 없이 간세포암 이종 이식 모델에서 종양 성장을 현저히 억제할 수 있었다.
ginsenoside C-K의 에스테르화 변형 후, 세포독성이 감소하고 항암 활성이 증가함을 알 수 있다.Wang 등은 PD의 C-3 hydroxyl group과 benzoic acid 유도체, amino acid 및 tetrachlorophthalic anhydride를 반응시켜 일련의 PD 유도체 21-31 [29]을 얻었다 (그림 5 참조). 항암 증식 시험 결과 인간 간암 세포인 HepG-2, 인간 폐암 세포인 A549, 인간 유방암 세포인 MCF-7, 인간 대장암 세포인 HCT-116 등 대부분의 화합물이 암 세포주에 억제 효과가 있는 것으로 나타났다.PD와 비교하여 ginsenoside 유도체 22, 23, 26은 암세포 증식 억제 효과가 유의적으로 나타났다.예를들어, 22 IC50 값이 가장 낮았A549 (IC50 = 18.91 ±. 03 μ mol/L), MCF-7 세포는 동안, 복합 23 보여주 더나은 억제 활동 (IC50 =. 62 ± 0. μ mol/L)다.이 결과는 진세노사이드 (ginsenosides)에 방향산을 도입하면 항암 활성도 현저히 향상시킬 수 있음을 보여준다.
상술한 구조-활성 관계는 긴세노사이드에 단사슬지방산이 도입되면 긴사슬지방산보다 더 좋은 활성을 나타낸다는 것을 보여준다.에스테르화 개량 부위 (모노에스테르와 폴리에스테르)의 수와 산의 종류 (지방산과 방향산)는 생물학적 활성에 큰 영향을 미치지 않는다.
아미노산 개량 2.1.2
인삼 열매에서 분리한 천연 화합물인 25-Hydroxyl-protopanaxdiol (25-OH-PPD) (34)은 상당한 항암 활성과 낮은 부작용과 높은 절대 경구 생체 이용성의 장점을 가지고 있다.Yuan et알다.[30]은 독특한 생리적 기능과 약효가있는 역할을 하는 비단백질 아미노산과 결합하여 일련의 새로운 25-OH-PPD 유도체 33-45를 설계하고 합성하였다 (그림 6 참조). 항암 활성은 일부 25-OH-PPD 유도체가 종양 증식에 대해 우수한 억제 활성을 보였다.예를들어, 복합 33 HCT116 강 한 antitumor 활동에 대한들을 보여주었고 BGC-823 세포, 238 μ mol/L의 IC50 값과 6.38 μ mol/L,각각다 (표 1 참조). 게다가, 아미노산의 파생상품 25-OH-PPD (46-59) 또한 전시 antitumor 활동 [31]다 (표 1 참조).
표 1에서 볼 수 있 듯이, 아미노산의 IC50 값 일부 첨가 수정 제품은 100 μ mol/L)보다 단백질 아미노산의 anti-tumor 활동하는 동안 수정 제품은 일반적으로 그것보다 더 좋은 아미노산의 첨가 수정 제품, 그리고 그들의 IC50 값은 모두 30 μ mol/L)보다 낮다.반면에, 아미노 산은와 함께 ginsenoside 파생상품에 IC50 값 이하의 10 μ mol/L anti-tumor 확산 모든 그룹이 나요 보호 및 제거 나요 보호 그룹 anti-tumor 활동이 현저히 낮 아진 제품의 지질을 간접적으로 증가하고 있 다는 것을나 타 냅하는 제품의 용해도를 통해 esterification ginsenoside 파생상품의 생물학적 활동을 크게 증가시 킬 수 있다.
무기산 개질 2.1.3
At present, inorganic acid modification mainly uses the sulfonating re에이전트chlorosulfonic acid to react with the hydroxyl groups on the ginsenoside sugar chain to form a sulfonate, which is then converted to a salt by neutralization with pyridine. As the introduction 의a sulfate group increases the polarity 의ginsenoside derivative, solubility is improved. It has been reported that the anticancer activity of sea cucumber saponins, which have a similar structure to ginsenosides, is related to the sulfate group,the fewer sulfate groups present on the sugar chain, the stronger the 항암activity [32].
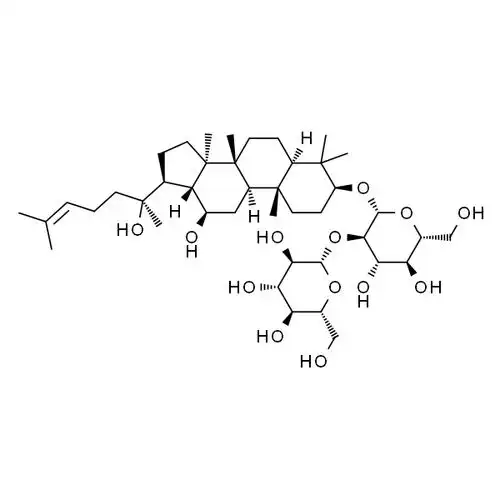
Based on these findings, Guo et알다.[33] used the chlorosulfonic acid-pyridine method to sulfate modify ginsenosides. The resulting derivative SMTG-d3 enhanced 자연killer cell activity by promoting the proliferation of T lymphocytes and the production of IFN-γ and TNF-α cytokines. Compared with ginsenoside, SMTG-d3 not only reduces cytotoxicity, but also further enhances antitumor immune activity. Previously, Fu et알다.[34-36] also used this method to convert the C-6 hydroxyl group 20 (S)의-ginsenosideRh2to a sulfonate ester and 합성two new derivatives 60 and 61 with greatly improved solubility (see Figure 7). Further studies have found that both derivatives can enhance 항 염증and immune 효과by blocking mitogen-activated protein kinase and the 릴리스of pro-inflammatory mediators 유도by activation. This shows that the sulfation of ginsenoside derivatives can increase their solubility, thereby enhancing 활동such as anti-inflammatory and anti-tumor effects.
2.2 산화적 수정
진세노사이드 사이드 사슬의 평면적인 이중 결합과 아글리콘 구조의 하이드록시기 (hydroxyl group)는 산화 변형을 위한 반응 장소를 제공하여 일부 진세노사이드의 C-17 사이드 사슬과 A, C 고리를 산화시킬 수 있게 한다.연구에 따르면 진세노사이드 측사슬의 이중결합이 용해도가 낮은 이유 중 하나라고 한다 [37].Ginsenosides는 산화적 변형을 통해 불포화도를 감소시키거나 카르복실기와 같은 이온화 그룹을 첨가함으로써 물에 대한 용해도를 증가시켜 생물학적 활성을 증진시킬 수 있다.
Wong 등 (38)은 ginsenoside 20(R)-Rh2 (2)의 side chain의 double bond를 산화시켜 산화시킨 azomethane/dextran sulfate sodium salt (AOM/DSS)에 의해 유도된 대장암의 발생을 효과적으로 방지할 수 있는 유도체 20(R)-Rh2E2 (62)를 얻었다 (그림 8 참조).이 에폭사이드 화합물은 다른 암세포주에 대해서도 억제 활성을 가지고 있다.예를들어, 폐암을 위한 IC50 세포 (LLC-1)는 56 μ mol/L.
PPD는 사람의 간에서 대사되어 피시놀 골격을 포함하고 항염증 활성이 좋은 C-20-24에폭사이드를 형성한다는 것이 밝혀졌다 [39].Wang etal.은 20(S)-PPD를 epoxidized 한 다음 Dess-Martin 산화, NaBH4로 선택적 환원, 응축 및 deprotection 반응을 거쳐 일련의 아미노산 변형 C-12 산화 된 Pyxinol 유도체를 얻었다 [40] (그림 9 참조) In vitro 세포 독성 시험 결과 대부분의 유도체는 유의한 독성 효과를 나타내지 않았다.
Using the Griess method to test the inhibitory activity of these derivatives on nitric oxide in RAW264.7 macrophages, derivatives 63a, 63b, 63c, 63d, 64e, 66b, and 66c showed good anti-inflammatory activity (inhibition rates of 48% to 85%), even better than Y13 (known as the Pyxinol derivative with the best anti-inflammatory activity at the C-12 site, with a hydroxyl group, and an inhibition rate of <40%) and the clinically approved glucocorticoid steroid drug hydrocortisone sodium succinate. 한structure-activity relationship study showed that oxidation of Pyxinol at the C-12 position can effectively improve the anti-inflammatory activity of derivatives modified at the C-3 position. In particular, N-Boc-protected aromatic amino acids can significantly enhance their anti-inflammatory activity. At the same time, derivatives with the absolute configuration of R at the C-24 position are more active.
Wang 등 41)은 이와 유사한 방법으로 피시놀 골격 a 링의 C-3위치를 선택적으로 산화시키고 동시에 Michael acceptor를 도입하여 24개의 새로운 ginsenoside 유도체 (67a-67h, 68a-68h, 69a-69h)를 준비하였다 (그림 10 참조).구조-활성 관계는 Michael 수용체와 ginsenoside PPD의 융합은 유도체의 항염증 활성을 강화시킬 수 있으며, Michael 수용체에 전자 인출 그룹이 존재하면 항염증 활성을 더욱 강화시키는 것으로 나타났다.PPD의 C-20위치를 tetrahydrofuran ring으로 수정하여 얻은 유도체의 항염증 활성은 크게 감소하였으나, a ring이 산화된 유도체의 항염증 활성은 거의 영향을 받지 않았으며, 이는 더 나아가 일부 ginsenosides의 항염증 생물학적 활성은 산화 변형을 통해 상당히 향상될 수 있음을 나타낸다.
Zhang 등 [42]은 PD를 가수분해하고 pyridinechlorochromate (PCC), O2 및 H2O2를 이용하여 산화시켜 일련의 C-17 side chain과 a 및 C 고리 산화 유도체를 얻었다 (그림 11 참조).항암 세포 검사 결과 일부 화합물은 A549 (인간 폐암), 8901 (인간 난소암) 등 6개 세포주에서 양성 대조군보다 우수한 항증식 활성을 나타냈다.예를들어, U87에 (인간의 신경 교종) 세포, 화합물 70, 78, 82 및 83 긍정적인 것보다 더 효과 적이었제어, 19.51의 화합물과 82 IC50을 피우고 있 ± 1. 00 μ mol/L.유방암에 MCF-7 (인간) 세포, 5-fluorouracil 및 경찰과 비교 했을 때, 71 화합물과 더나은 antitumor 82 전시 활동 (IC50 = 17.73~23.58 μ mol/L);또한 71과 74 화합물은 HeLa 세포에서 양호한 항증식 활성을 나타내었다.연구에 도입 enol 한 구조에 α-site의 반지를, 경찰이 파생상품 antitumor를 향상시 킬 수 있 활동의 전부는 아니지만 경찰이 파생상품들이 이것을 성취 결과의 산화 수정이다.예를 들어, H2O2로 추가 산화하여 얻은 화합물 81의 항증식 활성은 감소되었다.
이인성 변형 2.3
헤테로사이클릭 화합물은 구조적 다양성과 광범위한 생물학적 활동 때문에 약물 설계와 합성에 종종 사용되며, 이는 약물 유사 화학을 위한 이용 가능한 공간의 확장을 제공한다.시판되는 약물은 대부분 헤테로사이클릭 구조를 포함하고 있는데, 질소 헤테로사이사이클이 시판되는 약물 구조에서 가장 흔하다.약물 분자에서 흔히 발견되는 질소 헤테로사이클과 산소 헤테로사이클은 고독한 전자쌍을 포함하고 있어 수소 결합을 형성할 수 있으며, 이는 수용성을 향상시켜 생체 이용성을 높이는 데 도움이 된다.피페라진 고리와 피페리딘 고리는 시판되는 약품에서 매우 흔한 질소 헤테로사이클릭 구조입니다.이들은 더 파생되어 작은 화합물 라이브러리 [43]를 설립할 수 있으며, 이는 심층적인 구조-활동 관계 연구를 위해 더 많은 화합물을 설계하는 데 도움이 된다.연구에 따르면 천연물에 헤테로사이클을 도입하면"약리결합"의 원리와 수소결합수의 증가를 통해 유도체의 생물학적 활성과 용해도를 크게 향상시킬 수 있다 [44~45].현재 많은 연구들이 헤테로싸이클을 이용한 ginsenoside 유도체의 변형에 대해 보고하고 있다.그 중 질소함유 헤테로사이클릭 화합물은 세포독성이 낮고, 양호한 수용성, 투과성 및 생체이용성을 나타낸다.
피라졸은 인접한 두 개의 질소 원자로 구성된 5원자 헤테로사이클릭 화합물이다.이들은 항염증, 항바이러스 및 항우울제 효과 등의 다양한 약리학적 활성을 가지며 [46] 신약 개발에 널리 사용된다.또한 아이소사졸 유도체는 항균, 항바이러스 및 항암 효과 등의 다양한 생물학적 활성을 가지며, [47] 유기 합성에 널리 사용된다.이를 바탕으로 Dai 등 [48]은 피라졸과 아이소사졸 골격을 PD의 C-3위치에 도입하여 헤테로싸이클을 함유한 19개의 PD 유도체를 설계하고 합성하였으며 (그림 12 참조), 4개의 서로 다른 종양세포에 대한 항증식 활성을 연구하였다.그 결과 피라졸 고리와 PD의 한고리를 융합시켜 얻은 산물 86과 87이 상당한 항암 활성을 갖는 것으로 나타났다.예를들어, 86의 IC50는 14.15 ±. 13 μ mol/L HepG-2 세포에 대한, 그리고 87의 IC50는 13.44 ± 1.23 μ mol/L에 대한 A549, 이는 경찰의 네 배다.또 다른 3개 종양세포에 대한 억제효과도 더 크다.그러나 화합물 88과 89a-89i는 다수의 에스테르 결합과 방향족 고리와 같은 소수성 그룹의 존재로 인해 수용성이 낮아 항암 증식 활성이 떨어진다.유도체 88과 89a-89i의 구조에 있는 에스테르 결합을 아미드결합으로 치환하여 유도체 90a-90f를 얻어도 항암증식 활성은 향상되지 않았다.반면 in vitro 활성도 검사 결과는 87 >86, 89a >88, 그리고 90a>91, 이는 피라졸 개질 PD 유도체가 이소사졸 화합물보다 일반적으로 더 활성적임을 나타낸다.
피라진과 피리미딘 화합물은 광범위한 생물학적 활성을 나타내며,이 두 종류의 구조는 시판되는 약물 분자에서도 종종 발견된다 [49-50].Wang 등 51)은 pyrazine, oxadiazole, isoxazole, pyrazole 및 pyrimidine 헤테로 사이클로와 같은 헤테로 사이클로가 산화, 수소화, Claisen 에스테르 응축, 환원, 하이드 록시기 그룹의 보호 및 탈보호와 같은 고전적인 유기 반응을 통해 PPD의 C-2 및 C-3위치에 도입되었다.일련의 헤 테로 사이 클릭 20 명의 (S)-PPD 파생상품 합성 되어 융합 (그림 13 참조)과 그들의 수용체에 억제 효과 활성 핵 요인-κ B에 대한리 간 드 (RANKL)-induced osteoclast 차별화 평가 되었다.structure-activity 관계에 있 다는 것을 보여 준 PPD과 비교 했을 때, 외에 phenylpyrazole 파생상품의 억제 osteoclast 차별화 oxadiazole에 의해, isoxazole과 pyrazole 파생상품 five-membered 헤 테로 사이 클릭 수정 (93, 94 및 95a) 가 비슷 하거나 약간 더 강력 한 억제 활동 (IC50 = 3 μ mol/L)보다 PPD;pyrazine 및 pyrimidine (92, 96a)과 같은 6원자 헤테로사이clic 고리로 변형된 화합물의 저해 활성이 현저히 증가하는 반면.
화합물 96a의 우수한 활성을 바탕으로 연구 그룹은 pyrimidine 유도체를 추가로 수정했습니다 (그림 14 참조).그 결과의 적당 한 농도로 1. 0 μ mol/L, 대부분의 파생상품 거의 100% 억제 효과를 주었(96f 제외);의 농도에서 0. 1 μ mol/L, 메 틸 (96b)의 억제 효과와 향상에 틸 (96c) 상당히 수정 된 파생상품은,의 억제 활동하는 동안 methoxy (96d), ethoxy (96e)와 아미노 (96g) 화합물 거의 변함없이 그대로 수정 됩니다.연구진은 96b를 c-12-히드록시 또는 C-17 사이드 체인으로 구조적으로 더욱 변형시켰다 (그림 14 참조).그 결과 C-12 위치에 있는 수산 그룹으로 교체 가 매우 (98), oxime (99), α-hydroxy (100) 또는 아세 테이트 (101) 그룹 억제 활동의 상당 한 감소를 초래 했다.0. 01의 농도에서 μ mol/L, 98-101 거의 억제 효과 가 없 보여주었다.105 화합물을 보여주 최고의 억제 활동 (IC50 = 11. 8 nmol/L), 심지어의 농도에서 0. 01, μ mol/L)하는 것 보다는 낫 PPD 활동 (IC50 = 3 μ mol/L), 그리고 그것과 체외 모두에서 osteoclastogenesis 생체 실험을 억제 할 수 있을 것이다.
2.4 폴리머 개질
친수성 고분자계 개질 항암제는 부족한 표적 (target)을 보완할 수 있을 뿐만 아니라 약물의 수용성, 안정성, 생체 내 반감기 및 생체 이용성을 향상시킬 수 있다 [52].최근년간 약물전달기술이 신속히 발전하여 진세노사이드가 널리 연구되고있다.루 등 53)을 에스테르화 반응을 통해 수용성 O-carboxymethyl chitosan (O-CMC) (Rh2-conjugated O-CMC,O-CMC/Rh2) (106)을 사용한 Rh2 공중합체를 제조하였다 (그림 15 참조). 그 결과 106은 다공성이 높게 나타났으며, 구조 내 에스테르 결합은 pH에 민감하게 반응하였다.pH5.8에서는 Rh2의 방출속도가 초기단계에서 더 빨랐으므로 염증성 통증시 부상 부위의 pH 변화에 따라 Rh2의 방출속도를 조절할 수 있었다.O-carboxymethyl chitosan의 공중합체는 Rh2의 용해도를 증가시키고, 방출속도를 조절하며, 체내 작용기간을 연장시킴으로써 생체 내 생물학적 효능을 증진시켰다.그럼으로써 Rh2의 생체 내 생물학적 효능을 향상시킵니다.
Polyethylene glycol (PEG)은 개조가 용이하고, 생분해성, 생체적합성과 높은 약물캡슐화율을 갖는 장점이 있으므로 약물전달에 있어 큰 가능성을 보여준다.Mathiyalagan 등 [54]은 친수성 PEG와 소수성 Rh1 및 Rh2를 결합하여 두 종류의 수동적 표적 전달 ginsenoside 유도체를 합성하였다 (그림 15 참조).Rh1과 비교하여 PEG-Rh1 (107)은 사람 폐암 세포주 (A549)에서 더 높은 항암 활성을 보이는 반면, PEG-Rh1과 PEG-Rh2는 감염되지 않은 murine 대식세포주에서 세포독성을 나타내지 않는다 (RAW 264.7).그 중 PEG-Rh2 (108)는 일산화질소 생성을 크게 억제 할 수 있으므로 더 나은 항염증 활성을 나타냅니다.이는 PEG 중합체가 ginsenosides의 용해도를 향상시키고 세포독성을 감소시킬 뿐만 아니라 EPR (enhanced permeability and retention) 효과와 다양한 pH 조건을 통해 목표한 전달을 달성할 수 있음을 나타낸다.
2.5 공법 수정
TPP 혼합체는 강력한 미토콘드리아 표적 능력을 가지고 있으며, [55] 종양 세포의 미토콘드리아에 아드리아마이신과 시스플라틴을 포함한 항암제를 선택적으로 전달하는 데 사용되었다고 보고되었다.Ma 등 [56]은 ginsenoside 25-MeO-PPD,25-OH-PPD 및 PD의 타겟과 활성을 향상시키기 위해 C-3위치에 길이가 다른 알킬 사슬을 도입한 후, 말단부에 트리페닐포스핀 (TPP)을 공중합시켜 일련의 ginsenoside 공중합체를 합성하였다 (그림 16 참조).암세포주 (A549, MCF-7)와 정상세포 (GES-1)에 대한 증식 억제 연구 결과, 대부분의 활용가 해당 모화합물보다 더 활성화되었으며, 정상세포보다 암세포에서 더 강한 억제효과를 나타내었다.그 중 109는 MCF-7세포의 미토콘드리아에 축적되어 활성산소종 (reactive oxygen species, ROS)의 생성을 자극하고, 미토콘드리아 막 전위의 탈분극을 일으켜 세포사멸을 초래할 수 있다.그러므로, 높은 선택 성과 109 전시회 좋은 antiproliferative 효과 (IC50 = 0. 76 μ mol/L) MCF-7 세포에 있다.
2.6기타 수정 사항
진세노사이드의 구조적 개조는 상술한 5가지 방법 외에도 에테르화 (etherification), 알킬화 (alkylation), 촉매 수소화 (catalytic hydrogenation), 당화 (glycosylation) 등이 있다 [57-58].에테르화 (Etherification)와 알킬화 (alkylation)는 알칼리의 촉매 작용으로 진세노사이드 (ginsenosides)의 히드록시기 (hydroxyl group)와 할로알케인 (haloalkanes)의 반응을 포함한다.촉매 수소화는 진세노사이드의 단분자 구조에서 불포화 그룹을 포화 그룹으로 직접 수소화하는 촉매를 사용한다.당화 과정은 mannosyl, xylosyl, rhamnosyl 그룹과 같은 상응하는 공여 그룹을 ginsenosides의 hydroxyl 그룹으로 도입하는 것을 포함한다.예를 들어, 렌 등 (59)은 산화, 환원, 친핵성 치환 및 기타 반응을 통해 PPD 유도체의 C-20 OH에 당 공여제를 도입하여 당도가 다른 일련의 ginsenoside C-K 유도체를 준비하였다 [60-65].
3 요약
본 논문은 최근 진세노사이드 (ginsenosides)의 구조 변형 방법에 대해 검토한 것이다.이는 주로 유기산, 아미노산 및 무기산을 이용하여 아글리콘의 C-3 및 C-20위치에 있는 히드록시기와 ginsenosides의 당사슬에 있는 1차 히드록시기와 반응하여 에스테르 유도체를 얻는데, 이는 ginsenosides의 지질용해도 및 생물학적 이용성을 향상시키기 위함이다.구조-활성 관계에 대한 연구 결과 에스테르화 변형 후 ginsenoside 유도체의 활성은 다음과 같은 특성을 갖는 것으로 나타났다:불포화지방산>포화지방산, 단쇄지방산>긴 사슬 지방산.극성 그룹을 도입함으로써 황산 개질, 불포화도를 감소시키거나 카르복실기와 같은 이온화 그룹을 첨가함으로써 산화 개질, 수소 결합 수를 증가시킴으로써 헤테로사이clic 개질, 친수성 복합 개질 등은 모두 ginsenosides의 수용성 및 생물학적 이용성을 다양한 수준으로 향상시킬 수 있으며, 이들 유도체의 생물학적 활성을 크게 향상시킬 수 있다.이러한 수정 방법은 ginsenosides의 연구 및 개발 및 응용에 중요한 참고 자료를 제공합니다.
However, there are currently some deficiencies in the structural modification of ginsenosides: firstly, there are relatively few structural modification methods. Structural modification mainly involves introducing groups that can react with hydroxyl groups, making the sites and types of products of structural modification relatively simple, and leading to insufficient research on the structure-activity relationship. In particular, there is a relative lack of modification of the sugar chain. There are few reports on the replacement of the sugar chain and the splicing of the sugar chain essential for activity with other different types of aglycon or skeleton to enhance activity and broaden the scope of activity. Second, the lack of precision in structural modification results in low activity. Current research on the activity of ginsenoside derivatives mainly focuses on in vitro anti-tumor and anti-oxidant activities, and there is relatively little further research on in 생체 실험activity, with very few compounds entering clinical research. Third, the research on the activity of ginsenoside derivatives is not in-depth enough. There is very limited research on ginsenosides and their derivatives with immunostimulatory activity as vaccine adjuvants. The few studies on ginsenoside adjuvants mainly use crude ginsenoside extracts, and there is a lack of systematic research on the potential application value of ginsenosides and their derivatives as potent immunostimulants in vaccine adjuvants.
넷째, 현재의 구조개조는 주로 dammarane-type ginsenosides에 초점을 맞추고 있으며, oleanolic acid와 orcinol-type ginsenosides에 대한 개조는 상대적으로 적은 편이다.따라서 향후 구조개조는 군 및 구조 도입의 정확성 향상, 구조개량 방법 및 개량 부위 확대, 진세노사이드 유도체의 적용 범위 확대, 진세노사이드 약물 및 건강식품 개발을 위한 이론적 토대를 마련해야 한다.
참조:
[1] 호우 M, 왕 R, 자오 S등이 있다.panax 속의 Ginsenosides와 이들의 생합성 [J.Acta 제약학 Sinica B,2021, 11 (7):1813-1183.
[2]왕YH,AI ZY,장J D 등이 있다.항암 활성 및 ginsenosides의 기전 연구 진행 [J.식품산업과학기술, 2023, 44(1):485-491.
[3]PAIk S, SONG G Y,JO E K,외.산화적 스트레스의 변조를 통해 염증을 치료적으로 표적으로 하는 Ginsenosides.국제 면역 harmacology, 2023, 121:110461.
[4] 류 에프엑스,린 Z X,장 H L 등.인삼의 항피로 기전 및 잠재표적 분석.China 저널of Chinese Materia Medica, 2019, 44(24):5479-5487.
[5] 아링 N M, 밀스틴 D, 마크 L 한외.피로치료제로서의 인삼:체계적 고찰 [J].JAltern Complement Med. 2018, 24(7):624-633.
[6] 펑 S,리 T,웨이 X,정 Y등.희귀 한 ginsenosides의 항 산화 및 anti-Fatigue 효과와 γ-aminobutyric 산성 발효 된 인삼과에서 발아 현미 퓨 레다.International 저널of Molecular Sciences. 2024, 25(19):10359.
[7] 후 주석 Q R, 홍콩 H, 장 Z H, et 알다. 방법 on 개선 of the poor 경구 진세노사이드의 생물학적 이용성 (bioavailability of ginsenosides:Pre-processing, structural modification, drug combination, and micro-or nano-delivery system [J])인삼연구지 2023, 47 (6):694-705.
[8] 선풍기 W,선풍기 L, 왕 Z 등.희귀 진세노사이드:인삼 연구의 독특한 관점 (Rare ginsenosides:A unique perspective of 인삼연구) [J]다.대한고도학회지, 2024, https://doi.org/10.1016/j.jare.2024.01.003.
[9] 수 W,류 W, 듀안 C 외.희귀 ginsenosides Rg3의 제조 및 생리활성 (Preparation and bioactivity of the rare ginsenosides Rg3 그리고 Rh2:업데이트 된 리뷰 [J].피토테라피아, 2023, 167:105514.
[10]LI S, LI J,ZHAO Y 등이 있다.mannose-장식된 azocalixarene와 ginsenoside Rb1에 의한 다기능 나노물질의 초분자 통합 (Supramolecular integration of multifunctional nanomaterial by mannose-장식된 azocalixarene with ginsenoside Rb1 류마티스 관절염의 시너지 치료를 위해 [J.ACS Nano, 2023, 17 (24):25468-25482.
[11]Y한H,JIN H, FU Y 등.희귀 ginsenosides Rg3의 Panax 인삼 생산 및 [J]에서 종균에 의한 Rh2.한국농식품화학학회지 2019, 67 (31):8493-8499.
[12] 수 X, 규 W, 지아 Z 등이 있다.재배기간이 신품종 홍삼의 항염증 활성에 미치는 영향 (Effect of cultivation ages on anti-inflammatory activity of a newtype of red 삼)Biomedicine &약물치료, 2021, 136:111280.
[13] BEDNARCZYK-CWYNAR B,LE Ś KOWA, SZCZUKA 난, etal.oleanolic acid와 그 4가지 새로운 반인후제 유도체가 인간 mewo와 a375 흑색종 세포주에 미치는 영향 (J.제약, 2023, 16 (5):746.
[14] 등소 평의 X, KE J,정화 Y,et알다.Α synthesis 및 oleanolic의 생물활성 평가 -glucosidase 및-amylase 억제제로서 산성 옥심 에스테르 유도체 [J].효소저해 및 약용화학학회지, 2022, 37 (1):451-461.
[15]오Y,왕K, WANG J 등.다환질소함유 그룹을 갖는 ocotillol 유도체의 설계, 합성 및 항균평가 (J.미래약용화학, 2021, 13 (12):1025-1039.
[16]류J,GAN H, LI T 등.ocotillol [J]의 경구 투여 후 체내 대사산물 및 생체변환 경로.Biomedical Chromatography, 2020, 34 (8):e4856.
[17] 장 D, CAO Y, WANG K, et 알다. 설계, 합성, and 항균 평가 소설의 ocotillol 유도체 및 기존 항생제와의 시너지 효과 [J.분자, 2021, 26 (19):5969.
[18] 통이, 송 X, 장이 외.pp-type ginsenoside 유도체의 구조 변형, 생물학적 활성, 구조-활성 관계에 대한 인사이트.피토테라피아, 2022, 158:105135.
[19] 구오 H, XING Y, 태양 Y, et 알다. Ginsengenin derivatives synthesized 에서 20 (R)-panaxotriol: HIF-1 경로를 대상으로 하는 합성, 특성 및 항종양 활성 [J.인삼연구지 2022, 46 (6):738-749.
[20] 후 Q, 홍 H, 장즈 등.진세노사이드의 불량한 구강생체이용성의 개선 (Methods on improvements of the poor oral bioavailability of ginsenosides:Pre-processing, structural modification, drug combination, and micro-or nano-delivery system)인삼연구지 2023, 47 (6):694-705.
[21]리 J, DAI Y L, 정 샤 오 위 F, et 알다. 경구 흡수 and in vivo biotransformation ginsenosides의 [J].Chinese Journal of Biologicals, 2014, 27(12):1633-1636.
[22]LIANG J, TANG X, WAN S 등.ginsenoside Rh2의 구조 수정 그리고 암세포에 대한 cytostatic activity [J.ACS Omega, 2023, 8 (19):17245-17253.
[23]리 K K, 얀 X M,리 Z N 등.3가지 신규 ginsenoside M1의 합성 및 항암 활성 3'-ester 개조를 한 파생형 [J].바이오유기화학 (Bioorganic Chemistry), 2019, 90:103601.
[24] 황이,리 H 엠, 장이 X 외.합성과 생물학적 ginsenoside 화합물 K의 평가 파생상품의 소설 로서 계급 lxr α 활성다 [J다]분자, 2017, 22 (7):1232.
[25] 왕 R,리 M, 류 M등.SCFAs-modified debranched starch에 의한 피커링 유화의 특성 및 a 분만력이 있는 캡슐화 된 bioactive 화합물 [J]다.국제 Journal of 생물학적 거대 분자, 2023, 231:123164.
[26] 성키 R, 티모시 J K, 카즈토시 F 외.경구 astaxanthin prodrug (CDX-085) 가 ldlr-/-및 apoe-/-마우스의 지단백 수준과 동맥경화증의 진행에 미치는 영향 [J].Atherosclerosis, 2012, 222 쪽.
[27] 크리스토퍼 T C, 우다야나트 A, 크리스토퍼 A W 외.짧은 사슬 지방산-헥소사민 유사체를 이용한 친침습성 종양 유전자를 대상으로 하는 것은 전이성 mda-mb-231 유방암 세포의 이동성을 억제한다 [J].한국약용화학학회지, 2008, 51:8135-8147.
[28] 장 J, 통이, 루 X 등.ginsenoside C-K의 유래 및 간세포암종에 대한 억제효과 (J.생명과학, 2022, 304:120698.
[29] 샤오 S, 린즈, 왕 X 외.panaxadiol 유도체의 합성 및 세포독성 평가 (J.화학 &생물다양성, 2020, 17 (1):e1900516.
[30]YUAN W,GUO J, WANG X,etal.Non-protein amino acid derivatives of 25-methoxylprotopanaxadiol/25-hydroxyprotopanaxadioland their anti-tumor activity 평가 [J]다. 스테로이드, 2018, 129:1-8.
[31]LIN L, ZHAO Y, WANG P 등이 있다.ginsenoside AD-2의 아미노산 유도체는 세포골격에 영향을 주어 HepG2세포의 사멸을 유도한다 [J].분자, 2023, 28 (21):7400.
미야모토 [32] T, TOGAWA K, HIGUCHI R, et 알다. 6 새롭게 확인 생물학적으로 active triterpenoid glycoside sulfates from the sea 오이 cucurnaria echinata [J].Liebigs Annalen der Chemie, 1989 1990 (5):453-460.
[33]GUO Z,WANG L, HAQS 외.sulphation-modified total ginsenosides derivative-3의 in vitro immunomodulatory activity of sulphation-modified total ginsenosides derivative-3 [J].2016년 10월 10일에 확인함. 국경in Veterinary Science, 2023, 1068315.
[34] 푸 B, BI W, 그는 C, et 알다. Sulfated derivatives of 20 (S)-ginsenoside Rh2 and their inhibitory effects lps로 유도된 염증성 사이토카인과 매개체에 대하여 [J.피토테라피아, 2013, 84:303-307.
[35]BIW, FU B, 셴H 등.20(S)-ginsenoside Rh2의 황산 유도체 lps로 유도된 RAW264.7대식세포에서 mapks와 nf-kappa b 경로를 통해 염증성 사이토카인을 억제한다 [J].염증, 2012, 35:1659-1668.
[36] YIP, BI W, SHEN H, et 알다. 억제 effects of sulfated 20(S)-ginsenoside Rh2 on the release of lps로 유도된 RAW 264.7세포에서 pro-inflammatory 매개체 [J.European Journal of Pharmacology, 2013, 712:60-66.
[37]ZHOU W X, YANG N, ZHAO Y Q. 진세노사이드 (ginsenoside)의 수용성 향상에 대한 연구에 진전.약물평가연구, 2016, 39(2):322-327.
[38]WONG V, DONG H, LIANG X 등.새로운 대사 억제제인 Rh2E2는 특히 종양 세포의 에너지 기반 대사를 억제한다 [J].OncoTargets and Therapy, 2016, 7 (9):9907-9924.
[39] 태양이 X, 팡 X 제이, 가오 M 외.새로운 항염증제로서 pyxinol 유도체의 합성과 구조-활성 관계 (J.ACS 약용 화학 편지, 2020, 11, 457-463.
[40] 왕 Y, MI X, DU Y, et al. 설계, 합성, and anti-inflammatory activities of 12-dehydropyxinol 유도체 [J].분자, 2023, 28 (3):1307.
[41] 양지, 미 X, 왕이 외.michael-acceptors의 융합은 NLRP3의 잠재적인 조절자로서 ginsenosides의 항염증 활성을 향상시킨다 신호 경로 [J]다.2023년 바이오유기화학, 134:106467다.
[42] 장 이엠, 위안 W H, 왕 X D 외.ginsengdiol 산화와 질소 혼합 유도체의 합성, 특성 및 세포독성 활성 평가 (J.MedChemComm, 2018, 9(11):1910-1919.
[43] 샤오 S, 왕 X, 수 L 외.새로운 ginsenoside 유도체는 G1-phase arrest와 reactive oxygen species-mediate cell apoptosis를 유도함으로써 PC-3세포에 미치는 영향을 보여주었다 [J].Bioorganic Chemistry, 2021, 112:104864.
[44] 양 G Q, 류 S, 장 C 등.비기질로 아미노산 잔기를 갖는 피시놀 아미드 유도체 발견 allosteric 억제 제 p-glycoprotein-mediated의 multidrug 저항 [J]다. Journal of 약용화학, 2023, 66 (13):8628-8642.
[45]MA L, MIAO D, LEE J 외.잠재적 항암제로서 헤 테로 사이 클릭ring-fused dammarane-type ginsenoside 유도체의 합성 및 생물학적 평가 (J.Bioorganic Chemistry, 2021, 116:105365.
[46] 카루치 K, 라디 S, 람리가 외.피라졸 유도체의 합성 및 약리학적 활동:고찰.분자, 2018, 23(1):134.
[47] 왕 J, 왕 D B, 수이 L L, et al.천연 제품-isoxazole hybrids:약용 화학의 발전에 대한 고찰 (J).Arabian Journal of Chemistry, 2024, 17(6):105794.
[48] 다이 R, 웨이 X,리 T 등.panaxadiol pyrazole과 isooxazole 유도체의 합성 및 항암활성 [J.화학 &생물다양성, 2023, 20 (8):e202300507.
[49] 호우 W, 다이아 W, 황 H 등.피라진의 약리학적 활성과 기전 (J.European Journal of Medicinal Chemistry, 2023, 258:115544 쪽.
[50] 라시드 H 유, MARTINES M A 유, 두 아르테 A P, et al. 연구 발전 in the pyrimidines의 합성, 항염증 활성 및 구조-활성 관계 (J.RSC Advance. 2021, 11(11):6060-6098.
[51] 왕 S, 장 J, ZHANG J, et al. 합성 and biological 평가 of heterocyclic 강력한 항 골다공증 제제로서 ring-fused 20(s)-protopanaxadiol 유도체 [J].의약화학학회지, 2023, 66 (17):11965-11984.
[52] 양 K, 양 Z, 유 G 외.다프로약물 나노메디신 (Polyprodrug nanomedicines:An emerging paradigm for cancer therapy [J])첨단소재, 2022, 34 (6):e2107434.
[53] LU H, 스 템 J, 렌 Y, et al. 평가 of the anti-inflammatory 고통 효과 of 긴세노사이드 공중합체 o-카르복시메틸 키토산 입자 [J.고분자, 2023, 15 (19):4011.
[54]MATHIYALAGAN R, WANG C, KIM Y, 외.polyethylene glycol-ginsenoside Rh1의 제조 그리고 Rh2 conjugates와 폐암 및 염증에 대한 효능 [J.분자, 2019, 24 (23):4367.
[55] 바테하 S, 굽타 S, 테자바트 K K 등.tp 기반 conjugates:potential targeting ligands [J].약물 발견 오늘. 2024, 29(6):103983.
[56] 마 L, 왕 X,리 W 등 triphenylphosphonium-ginsenoside의 설계, 합성 및 생물학적 평가 conjugates as mitochondria-targeting anti-cancer 에이전트 [J]다. Bioorganic Chemistry, 2020, 103:104150.
[57] 장 H R, 예 AQ, 장 Y W 외.ginsenoside 유도체화와 그 생물학적 활동에 대한 연구 진행 [J.중국의 전통 및 한방약재, 2022, 53(14):4554-4567.
[58] 위안 S Z, WANG B, 저 우 X, et al. 희귀진세노사이드 생물형질전환 연구 진행 [J]다.식품산업과학기술, 2023, 44(12):480-489.
[59]RRN S, 류 R, 왕이 외.항천식 약제로서의 ginsenoside compound K 유사체의 합성 및 생물학적 평가 (J.Bioorganic &약용화학편지, 2019, 29 (1):51-55.
[60] 렌 G, LV W, 딩 Y 외.인삼 사포닌 대사체 20(S)-protopanaxadiol은 다중 표적 신호 경로에 의해 폐섬유증을 완화한다 [J].인삼연구지 2023, 47 (4):543-551.
[61] 장 H, 장 L, 양 C 외.protopanaxadiol-type 사포닌 사포닌과 protopanaxatriol-type의 방제 효과 saponins on myelosuppression 쥐 induced by cyclophosphamide [J]다. Frontiers 약리학에서, 2022, 13:845034.
[62] 김아, 박 SM, 김 NS 외.파낙스 인삼의 활성 성분인 GinsenosideRc는 미토콘드리아 생체 발생 개선을 통해 산화적 스트레스로 유발된 근위축을 완화시킨다 [J].산화방지제, 2023, 12 (8).
[63]LI S, LI JJ, ZHAO YY 등이 있다.mannose-장식된 azocalixarene와 ginsenoside Rb1에 의한 다기능 나노물질의 초분자 통합 (Supramolecular integration of multifunctional nanomaterial by mannose-장식된 azocalixarene with ginsenoside Rb1 류마티스 관절염의 시너지 치료를 위해 [J.ACS Nano, 2023, 17 (24):25468-25482.
[64]LEE H, KONG G, TRAN Q 등.ginsenoside Rg3 와의 관계 그리고 대사증후군 [J.Frontiers in Pharmacology, 2020, 11:130 쪽
첸 [65] Y Y, LIU Q P, AN P, et al. Ginsenoside Rd: A 유망 한 natural neuroprotective agent [J]다.Phytomedicine, 2022, 95:153883.


 영어
영어 프랑스
프랑스 스페인
스페인 러시아
러시아 한국
한국 일본
일본