Nanoginsenoside Preparion에 관한 연구
인삼 has an important place 에서traditional Chinese medicine, 그리고its medicinal value was recorded as early as 에서Shennong's 마테리아 [1]의 고전.진세노사이드 (ginsenoside)는 인삼에 함유된 약리학적으로 가장 중요한 성분 중 하나이다.혈당조절 [2], 항종양 [3], 항염증 [4], 신경보호 [5], 항피로 [6]등과 같은 다양한 약리학적 효과를 가지고 있지만, 물에 잘 녹지 않고 생체 이용성이 낮으며 흡수가 잘 되지 않기 때문에 [7]임상 적용에 있어 일정한 단점이 있다.최근 나노의학 기술의 발전과 함께 21세기 천연물 의약품의 대표주자의 하나인 진세노사이드 (ginsenoside) 가 진세노사이드와 관련된 나노의학 전달시스템 개발에 있어 연구자들의 관심을 끌고 있다.따라서 필자는 진세노사이드 나노메디신에 대한 현재 연구를 검토하면서 향후 관련 준비물 개발에 참고가 되고자 한다.
1 도입
인삼 사포닌 1.1
1960년대 이후, 연구원들은 인삼에서 100가지 이상의 인삼 사포닌을 분리했다.이들의 화학 구조는 주로 아글리콘과 설탕 치환기 [8]로 구성되어 있다.인삼 사포닌은 아글리콘과 당의 차이에 따라 dammarane 형과 oleanane 형으로 나눌 수 있다.당 그룹의 위치에 따라 담마라네 타입의 진세노사이드를 두 종류로 나눌 수 있는데, 담마라네 고리의 C-3 및 C-20위치에 당 그룹이 부착된 것을 프로토파낙사디올 타입 (protopanaxadiol type) 이라고하고, 다마라네 고리의 C-6 및 C-20위치에 당 그룹이 부착된 것을 프로토파낙사트리올 타입 (protopanaxatriol type) 이라고 한다.다양한 종류의 진세노사이드의 화학구조는 그림 1 [9-11]에 나타나 있다.
The ginsenosides that have been widely studied are mainly of the damarane type, such as ginsenosides CK,Rb1, Rg3, Rh2, Re, Rh1 그리고Rg1, etc. The specific chemical structures are shown 에서Table 1 [11-12]. However, due to the poor membrane permeability of ginsenosides, the oral bioavailability is usually less than 5%, and the efficacy of direct application is not good [7]. Exploring suitable 마약배달시스템is an important means of enhancing their medicinal value.
1.2 나노 의학 전달 시스템
나노기술의 발전은 많은 나노의기의 발전을 촉진하였다.나노메디톡스는 넓은 특정 표면적과 강한 안정성, 높은 약물 적재량 등 독특한 약동학적 효과로 인해 널리 연구되고 있다.나노 의학 전달 시스템이 용해도 증가, 약물 안정성 향상, 약물 흡수 촉진, 약물 방출 조절, 면역 인식 회피 등을 통해 약물 효능을 향상시킬 수 있다는 것이 밝혀졌다 [13-15].나노 약물의 표적 개량은 병리 부위에 약물을 더 정확하게 전달할 수 있고 [16-17], 약리학적 효과가 다른 여러 약물을 공동 적재하면 치료 효과를 높이고 부작용을 줄일 수 있다 [18-19].또한 나노약물은 종양 치료를 위해 널리 연구되고 있다 [20].많은 학자들은 EPR 효과 (투과성 및 유지효과 강화)와 같은 나노약물의 종양 표적에 대한 지지이론을 제시했는데, 즉, 고형 종양 조직은 혈관 밀도가 높고, 구조 온전성이 떨어지며, 림프관 역류 장애, 국소 혈관 투과성 중간 농도가 높은 특성을 가지고 있어 나노 입자, 리포좀 및 일부 대형 분자 물질이 종양 조직에 더 쉽게 들어가 남아 있다는 것이다 [21-22].나노제형으로 진세노사이드를 준비하는 것은 치료 효과를 높이는 효과적인 방법이다.
치료약으로서 진세노사이드 2
2. 1 정자
미셀은 양친성 분자 [23] 가 자기 조립하여 형성된 나노 규모의 거대 분자들의 순서 집합체이다.분자 사슬의 소수성 부분은 micelle의 핵을 이루고, 친수성 부분은 shell [24]을 이룬다.양친성 분자는 잘 녹지 않는 약물을 캡슐화하여 물에 대한 약물 용해도를 향상시키고, 약물 안정성을 향상시키고, 혈액 내 순환 시간을 연장하고, 조직 분포를 변경하고 5치료 효과를 향상시키는 데 사용할 수 있습니다 [25].
Ginsenoside CK is the main metabolite of protopanaxadiol-type saponins and has a significant inhibitory effect on a variety of tumor cells [26]. However, CK has poor water solubility and low bioavailability, which limits its clinical application. Zhang et알다.[17] prepared a ginseng saponin CK polymer micelle APD-CK with deoxycholic acid-O-carboxymethylchitosan as the carrier modified with a liver cancer-specific targeting peptide A54.
A54 펩타이드의 변형을 통해 APD-CK는 간암세포를 선택적으로 표적으로 삼을 수 있다.48 h의 이후의 IC50 값 APD-CK HepG2 세포에 대한 조치 가 16.32 μ g · mL-1,는 자유의 그것보다 훨씬 낮 CK (28.19 μ g · mL-1)다.또한, APD-CK에서 약물의 방출은 pH-resistant 이며, 산성 조건에서 더 쉽게 방출됩니다.이 미셀은 약간의 리소좀 타겟팅 능력도 가지고 있을 수 있다.물리적 내장 외에도 운반체에 화학적으로 약물을 연결하는 것 또한 약물이 적재된 미셀을 준비하는 일반적인 수단입니다.Li 등 (27)은 ginsenosideRh2와 triptolide를 사용하여 에스테르화 PEG를 이중 종료하여,"소수성-친수성-소수성"트리 블록 중합체를 성공적으로 제조하였다.이 고분자는 미셀로 자체 조립할 수 있으며 소수성 약물의 전달에 사용될 수 있습니다.낮은 pH 조건과 혈청 가수분해효소의 작용으로 약물을 방출하며, 폐암 치료에 안정적인 복합 약물 전달 시스템으로 사용할 수 있습니다.
2. 2 Liposomes
Liposomes are tiny double-layered vesicles composed of amphiphilic phospholipids. Cholesterol is embedded in the membrane to enhance stability. Hydrophobic drugs can be encapsulated inside the lipid bilayer, while hydrophilic drugs can be embedded in the hydrophilic layer of the lipid membrane [28]. Compared with polymericnanoparticles, they have fewer adverse reactions and are biocompatible. At present, the few FDA-approved nanoformulations are mainly liposomes을intravenous injection [29-30].
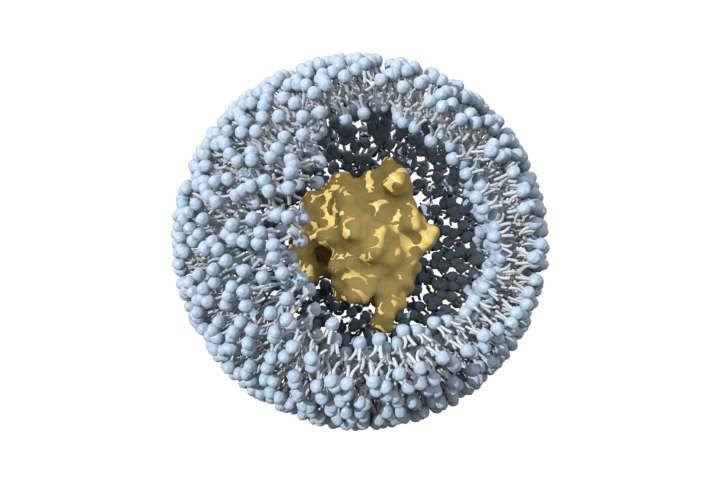
Ginsenoside Rh2 has a good 항암effect in 체외and in vivo, but due to its hydrophobicity and significant efflux mediated by ABCtransporters, its bioavailability is very low [31]. Xu et알다.[32] prepared mPEG-PLA modified long circulating liposomes Rh2-PLPand and an octadecylamine-modified cationic liposome (Rh2-CLP). Compared with conventional liposome Rh2-LP,both have better physicochemical and biological properties in vitro and in vivo. PLP can targetdrug 배달to tumor tissue. The fluorescence intensity of DiR-labeled PLP in mouse tumor tissue was 1.3 times that of CLP and 1.6 times that of LP. In vivo anti-tumor studies have shown that Rh2-PLP has the strongest tumor inhibitory effect. This property may be attributed to the PEG modification, which can shield the recognition of liposomes by the reticuloendothelial system (RES), prolong the circulation time of liposomes in the blood, and thus achieve passive targeting of tumors. In addition, other studies have found that the affinity of saponins 을cholesterol and phospholipids can affect the structure and formation of liposomes. When the interaction between cholesterol and phospholipids is stronger than that between cholesterol and saponins, it is more conducive to the stability of liposomes [33-34].
2. 3 Nanomilks
나노에멀젼은 열역학적으로 안정한 시스템으로 오일상 (oil phase), 물상 (water phase), 계면활성제 (surfactant) 또는 공유화제 (co-emulsifier)로 구성되어 있다.보통 약물과 엑시언트를 고르게 분산시키기 위해서는 강한 기계적인 힘이 필요하다 [35].그러나 준비 과정에서 계면활성제가 적게 필요하고 물방울 크기가 작으며 [36] 약물의 흡수를 높일 수 있다.경구, 주사, 그리고 피부에 국소적으로 투여했을 때 생리활성 물질의 조절된 방출에 대해 연구되어 왔다 [37-39].
Ginsenoside Rg1 has low membrane permeability and is not effective when taken orally [40]. In order to improve the oral bioavailability of Rg1, Khattab et알다.[41] used Caproyl 90, IPMand Labrafil M1944 as the oil phase, Tween 80, Cremophor EL and Tween 20 as the surfactants, Transcutol HP and propylene glycol as co-surfactants, prepared a Rg1-loaded nanoemulsion SNES. SNEShas an ultra-small particle size of 10.05–13.32 nm, which effectively avoids the phagocytosis of RES. The lipid components in the preparation enhance the ability of Rg1 to penetrate the blood-brain barrier, thereby providing higher brain targeting. After oral administration, the metabolites of the lipid components in SNES,such as diacylglycerides, monoglycerides and fatty acids, form mixed 정자with bile acids, which promote the absorption of Rg1 into the blood circulation through the lymphatic system, thereby avoiding the first-pass effect. This nanomilky solution may be an alternative treatment for obese patients with orlistat metabolic disorders.

알부민 나노입자 2.4
Albumin is abundant in serum and has the advantages of being non-toxic, non-immunogenic, biocompatible, and easily chemically modified. Based on these properties, albumin nanoparticles have been widely studied for the 배달of various types of molecules, including chemical drugs, proteins/peptides, and oligonucleotides [42-44].
Zhang 등 (45)은 mPEG-SA를 선택하여 ginsenoside Rg3에 free hydroxyl group을 에스테르화 시키고 운반체로서 bovine serum albumin (BSA)을 사용하여 약물부하 알부민 나노입자 mPEG-Rg3-BSA NPs를 제조하였다.친수성 mPEG의 도입은 약물의 혈액 순환을 현저히 연장시킬 수 있으며, 이는 mPEG-Rg3-BSA NPs 가 EPR 효과를 얻는 데 도움이 된다.종양 부위의 dir-label mPEG-Rg3-BSA NPs의 형광 강도는 free DiR보다 5.4배 높습니다.무료 Rg3와 비교하여 mPEG-Rg3-BSA NPs는 치료 효과를 향상시킵니다.진세노사이드 Rg5는 수용성이 낮고 생체이용성이 떨어진다.동 등 (46)은 탈지법을 이용하여 엽산 (FA) 표적 변형된 소혈청 알부민 나노입자를 Rg5 (FA-Rg5-BSA NPs) 가 loaded 되었다.이러한 나노입자는 표면에 많은 양의 FA로 인해 종양세포를 특이적으로 표적으로 하며, 수용체 매개 내분비를 통해 나노입자 흡수 및 내부화를 향상시켜 종양세포의 사멸을 유도한다.마우스에서 MCF-7인간 유방암의 치료 모델에서 Rg5가 효과적으로 종양 부위에 빠르게 (8시간) 축적될 수 있음이 관찰되었고, 마우스에서 종양 체중 억제율이 (79.25±6.36)%에 도달하여 FA 변형이 없는 free Rg5 (48.84±9.74%) 및 Rg5-BSA NPs (69.91±11.77%)보다 유의하게 높았다.
금속 나노입자 2.5
금속 입자를 약물 전달체로 사용하면 정전기력, 수소결합, 반데르발스력 등의 상호작용을 통해 약물이 금속 운반체 표면에 적재될 수 있다.최근 금속 나노입자는 특정 표면적이 크고, 기능 개조가 용이하며, 안정성이 높고, 약물 적재량이 높아 많은 관심을 끌고 있다.이들은 종양 영상, 표적 치료 및 광열 치료 [47-49]에서 널리 연구되었습니다.
Due to the good biocompatibility and automatic liver targeting function of iron-based nanoparticles, Ren et알다.[50] prepared Fe@Fe3O4 nanoparticles Np Rg3 coupled with ginsenoside Rg3, 간세포암 (HCC) 발생을 현저히 억제할 수 있으며, HCC의 폐 전이를 제거하고 간암에 걸린 생쥐의 생존을 효과적으로 연장합니다.또 나노입자는 장내 미생물과 신진대사 사이의 불균형한 네트워크를 재구성해 HCC로 유발된 장내 미생물 변화를 최소 12주 지연시켜 HCC 치료에 새로운 전략을 제공할 수 있다.이밖에 광온열치료와 화학요법을 병행하는 것도 암치료의 중요한 수단이다.Kim 등 51)은 Lactobacillus acidophilus DCY51T를 이용하여 ginsenoside CK-Au 나노입자를 제조하였다.표면에 현탁전하를 가지고 있는 것.이들이 EPR 효과를 리용하여 종양조직에 도달하면 종양세포의 음이온표면에 결합할수 있고 내분비작용을 통해 종양세포에 침입하여 종양세포의 용해를 촉진할수 있다.635 nm 적외선 광치료와 병행할 경우 인체 위암세포의 증식 억제 효과가 더욱 향상되며, 광열 및 화학 요법에 효과적인 시너지 치료제입니다.

3인삼 사포닌을 약물전달체로 한다
3.인삼 saponins마약 운반책으로
진세노사이드의 독특한 화학 구조는 운반체와 치료제의 기능을 결합한 새로운 형태의 약물 운반체로서 가치를 갖게 한다.
(1) 진세노사이드는 소수성 담마란 또는 올레아난 구조와 친수성 포도당 모이티 (hydrophilic glucose moiety) [8]를 모두 가지며, 자기조합 나노입자, 미셀을 형성하거나 나노에멀전 (nanoemulsions)에서 계면활성제 역할을 할 수 있다 [19, 52-54].(2) 인삼 사포닌은 스테롤 구조를 가지고 있으며 새로운 형태의 지방막 안정제로서 콜레스테롤을 대체할 수 있습니다.안정성이 우수하고 종양을 타겟팅하는 성질이 강하다 [55-56].(3) 인삼 사포닌은 세포막의 인지질과 상호작용할 수 있다.약물 전달체로 사용될 경우, 이들은 세포막과 접촉할 때 일시적인 틈을 발생시켜 약물의 세포 흡수량을 증가시킬 수 있으며, 비교적 짧은 시간 내에 세포막의 온전성을 회복할 수 있다 [53].(4) ginsenosides의 구조에서 glycosyl group은 포도당 수송체 1 (GLUT1)의 기질이다.GLUT1은 일부 종양 세포에서 특이적으로 발현되므로, ginsenosides 자체도 특정한 종양을 표적으로 하는 특성을 가지고 있다 [57-58].(5) GLUT1은 혈뇌장벽의 주요 수송체이기도 합니다.또한 글리코실 그룹을 함유한 인삼 사포닌은 혈액-뇌 장벽을 넘을 수 있으며, 뇌에서의 표적 약물 전달에 대한 확실한 가능성을 가지고 있다 [56, 59].
(2)
약물 전달체로서의 진세노사이드 적용 3.2
3.2.1자기조립 나노입자의 직접 형성
Based on the amphiphilic molecular ginsenosides의 구조, 그들은 스스로 나노 입자를 형성하고 운반체로서 다른 약물을 코팅할 수 있습니다.Dai 등 [52]은 용해도가 낮은 천연항암화합물 (betulinic acid, dihydroartemisinin, hydroxycamptothecin)을 전달하기 위해 자기조합된 ginsenoside Rb1 미셀을 사용하였다.준비된 나노입자는 높은 약물 적재 능력 (20%-35%), 강한 종양 표적 및 긴 약물 반감기를 가졌다.Li) 등 19명은 박막분산법을 이용하여 10 nm 이하의 입자크기를 갖는 diclofenac-loaded microemulsion 인삼 saponin Rb1 미셀을 제조하는데 성공하였다.생체 토끼 안구 각막 침투 연구는 미셀이 고농도의 디클로페낙 (diclofenac)을 각막에 전달할 수 있다는 것을 보여주었습니다.1회 투여 후 Rb1-Dic 투여군의 diclofenac 수치는 0.5시간, 1시간 및 2시간 시점에서 상용화된 diclofenac 안과 용액군에 비해 각각 137.54%, 74.93%, 255.43% 높은 수치를 나타내 눈의 염증성 질환 치료의 새로운 전략을 제시했다.조우 등 (53)은 인삼 사포닌 추출물을 피부 가수분해효소에 의해 INS 가 파괴되지 않도록 보호할 수 있는 ginsenoside 가 함유된 인슐린 (INS) 진세노사이드 나노입자를 박막 분산에 의해 제조한 막 소재로 사용하였다.또한이 나노입자는 세포간 지질장벽을 가역적으로 파괴함으로써 15분 이내에 세포내로 빠르게 침투할 수 있으며, 이를 바탕으로 skin's 저수지 효과, 당뇨병 쥐 치료 모델에서 제형의 저혈당 효능은 48시간 동안 초기 수준의 약 50%로 유지되었다.
리포좀용 막 안정제3.2.2
진세노사이드는 콜레스테롤과 유사한 화학구조를 가지고 있어 콜레스테롤 대신 리포솜의 세포막 안정제로 사용될 수 있다.홍 등 (55)은 ginsenoside Rh2와 인지질을 이용하여 paclitaxel을 함유한 리포좀 (liposomes)을 제조하였으며, Rh2가 리포좀 (liposomes)의 안정성을 높이고, 혈액 내 약물의 순환 시간을 연장하며, 종양내 약물의 축적을 촉진하고 면역억제 미세환경을 역행시키는 우수한 특성을 가지고 있음을 확인하였다.Chen 등 [58]은 추가로 c-3가 치환된 당 그룹 (ginsenosides Rg3 및 Rh2 등)이 리포좀의 혈액 순환 시간을 연장하고 4T1세포 표면에 발현된 GLUT1에 특이적으로 결합하여 종양의 표적 능력을 강화한다는 것을 발견했다.진세노사이드 구조의 당 잔류물은 혈액-뇌 장벽 [59]의 포도당 수송체를 위한 기질이다.주 등 (56)은 뇌종양 표적치료를 위해 혈액뇌장벽을 넘을 수도 있는 파클리택셀이 장전된 리포좀 Rg3-PTX-LPs를 준비하기 위해 ginsenoside Rg3를 세포막 소재로 사용하였다.쥐에 대한 Rg3-PTX-LPs IC 50 C6 신경 교종 세포는 0.045 μ g · mL-1,는 콜레스테롤의 그것보다 훨씬 낮 liposomes C-PTX-LPs (0.149 μ g · mL-1)다.생체내 형광영상 결과 Rg3-LPs의 신경교종 영역에서 검출된 DiR 신호 강도는 C-LPs의 약 3배였으며, 생쥐의 Rg3-LPs 제거가 C-LPs보다 느리고, 심지어 PEG-C-LPs에 근접한 것으로 검출되었다.이런 류형의 지방질은 또 일정한 장기순환효과가 있다.
나노멀션으로서의 계면활성제3.2.3
또한 진세노사이드는 화학 구조가 소수성 그룹과 친수성 그룹을 모두 포함하고 있기 때문에 천연 계면활성제 [60] 이기도하다.이들은 현재 새로운 기능성 식품의 설계 및 개발에 활용하기 위해 연구되고 있다.Shu 등 [54]은 콩기름에 astaxanthin을 기름상으로, ginsenosides를 고순도의 물에 수용액으로 분산시켰다.그들은 고압 균질화를 통해 아스타잔틴을 함유한 나노 에멀젼을 성공적으로 제조하였다.비교적 낮은 수준에서도 ginsenoside는 기름과 물 인터페이스 사이의 계면 장력을 효과적으로 줄일 수 있습니다.특정 농도 범위 내에서 진세노사이드의 농도가 증가하면 물방울 크기가 점점 작아진다.그러나이 나노밀키 에멀젼을 더 높은 온도에서 저장하면 astaxanthin의 분해속도가 너무 빠르다는 점과 계면활성제로서 ginsenoside 가 에멀젼의 안정성에 미치는 구체적인 영향은 더 많은 연구가 필요하다는 점에 주목할 필요가 있다.
4 결론 및 전망
진세노사이드는 다양한 약리학적 활성을 가지고 있어 개발 가능성이 큰 천연물 의약품이다.그러나 소수성이 높고 경구 생체 이용성이 낮아 임상 적용에 한계가 있다.나노 복용량 형태의 개발은 많은 잘 용해되지 않는 약물에 실용적인 응용의 수단을 제공합니다.진세노사이드는 미셀, 리포좀, 나노밀, 알부민 나노입자, 금속 나노입자 등의 나노캐리어들에 직접 캡슐화 될 수 있으며, 이들의 생체이용성을 효과적으로 향상시킬 수 있다.또한, 소수성 진세노사이드 구조의 친수성 당 그룹은 일정한 계면활성제 특성을 부여하며, 이를 이용하여 나노입자를 형성하거나 나노에뮬레이트의 계면활성제로 작용할 수 있다.뿐만 아니라 진세노사이드는 콜레스테롤과 유사한 구조를 가지고 있으며, 리포솜의 막 안정제로도 사용되어 안정성을 높일 수 있다.일반적으로 나노제형으로 진세노사이드를 준비하면 생체이용성을 향상시킬 수 있다.또한 Ginsenosides는 나노 제조의 특성을 향상시키기 위해 운반체 소재로도 사용될 수 있습니다.다른 약물을 캡슐화하는 데 사용하면 시너지 치료 효과도 얻을 수 있으며, 개발 가치와 응용 가능성이 큽니다.그러나 현 단계에서 약물전달체로서의 진세노사이드에 대한 연구는 아직 걸음마 단계이며, 관련 제형의 개발을 위해서는 추가적인 연구가 필요하다.

참조:
[1] Sun Xingyan, Sun Fengyi, comp. Shennong's 클래식 Materia Medica [M].북경:상업신문 1955:9.
[2] SABA, E 김S H,KIM S D, 외.서양식이요법 LDL-/-마우스에서 ginsenoside rg3 농축 홍삼 추출물에 의한 당뇨합병증 완화.J인삼res, 2018,42(3):352-355.
[3] 로사 M T M G, 실바 E K, 산토스 D T 등.바이오 계면활성제로 브라질 인삼 뿌리에서 추출한 수용액 추출물을 이용하여 초음파하여 annatto seed oil 미니 에멀젼을 얻음 [J. JFood Eng, 2016,168:382-390.
[4] Qi B, Zhang S, Guo D, 외.급성 간손상을 유발한 사염화탄소에 대한 ginsenoside Rg1의 보호효과 및 기전 [J.Mol Med Rep, 2017, 16(3):2814-2822.
[5] WANG R,LI Y N, WANG G J,외.ginsenoside Rg1의 신경 보호 효과와 뇌 수송 (J.Chin J Nat 약품, 2009,7(4):315-320.
[6] YANG Q Y,LAI X D, JING O Y 외.ginsenoside Rg3가 노화쥐의 피로저항성 및 SIRT1에 미치는 영향 (J.Toxicology, 2018,409:144-151.
[7] KIM H, 리 J H, 김제이 (KIM J E), et 알다. 마이크로-/청소기 delivery 시스템 ginsenosides의 개선을 위한 전신 bioavailability다 [J다]J 인삼res, 2018,42(3):361-369.
[8] CHEN W, BALAN P,POPOVICH D G. Chapter 6-아시아 인삼 (Panax 인삼)과 미국 인삼 (Panax quinquefolius L.)의 진세노사이드 성분 비교 및 이들의 변화경로 [J].Stud Nat Prod Chem, 2019,63:161-195.
[9]. MOHANAN P,SUBRAMANIYAM S, MATHIYALAGAN R, 외.진세노사이드 (ginsenosides) Rb1, Rg1 및 Rg3의 분자신호와 그 작용방식 [J.J 인삼res, 2018,42(2):123-132.
[10] 수 X H,리 T, 퐁 CM V 등.항암제로 한약에서 추출한 사포닌 [J.분자, 2016,21(10):1326.
[11] WANG H, ZHENG Y, SUN Q 외.이중 기능성 약물로 부상하는 진세노사이드 (Ginsenosides)와 항암치료 강화용 나노캐리어 (nanocarriers) [J.J Nanobiotechnol, 2021,19(1):322.
[12] PIAO X M, ZHANG H, KANG J P, 외.연구논문:파낙스인삼의 saponin 다양성에 관한 연구 (Advances in ginseng diversity of panax 인삼 [J])분자, 2020,25(15):3452.
[13] BISWAS S, 쿠 마리 P, LAKHANI P M, et 알다. 최근 발전 in polymeric micelles for anti-cancer 마약 배달 [J]이다.Eur J Pharm Sci, 2016,83:184-202.
[14] SHISHIR M R I, XIE L H, SUN C D, 외.바이오폴리머 및 lipid-based transporters를 이용한 생리 활성 화합물의 마이크로 및 나노 캡슐화 (Advances in micro and nano-encapsulation of bioactive compound 사용biopolymer and lipid-based transporters)Trends Food Sci Tech, 2018,78:34-60.
[15] DEY T K, KOLEY H, GHOSH M 등.나노사이징이 water nanoemulsion의 EPA-DHA rich oil 로부터 지질 생물학적 접근성과 ex vivo 생물학적 이용성에 미치는 영향 [J].식품화학, 2018,275:135-142.
[16] HOON H, HO P M, GAYOUNG J, 외.유방암 치료를 위해 엽산 기능화된 시클로 덱스트린-파클리탁셀 복합체를 함유한 글리콜 키토산 하이드로겔을 주사할 수 있다 [J].나노소재, 2021,11(2):317.
[17] 장 J M, 장 YY,리 YP.간암세포에 대한 ginsenoside compound K의 표적 세포 내 전달을 위해 achitosan-derived homing peptide로 변형된 미셀 [J].Carbohydr Polym, 2020,230:115576입니다.
[18] SUN J J, LIU Y H, CHEN Y C 등이 있다.독소루비신은 복합요법을 위한 산화환원반응 다사티닙 함유 중합체 프로약물 전달체에 의해 전달되었다 [J].J 제어 해제, 2017,258:43-55.
[19]리 M S, 란 J,리 X F 등.진세노사이드 Rb1기반의 새로운 초소형 미셀:안구 약물 전달을 위한 잠재적 나노 플랫폼 [J].약물전달, 2019,26(1):481-489.
[20] GABIZON A A, ROSALES R T M D, LA-BECK N M. Translational considerations in nanomedicine:the oncology perspective[J].Adv 약물전달 Rev, 2020,158:140-157.
[21] GOLOMBEK S K, MAY J N, THEEK B 외.종양 표적화 (Tumor targeting via EPR:strategies to enhance patient responses[J])Adv Drug Deliver Rev, 2018,130:17-38.
[22] PARK J, CHOI Y, 장 씨는H 등.부제:Alliance with EPR Effect:combined strategies to improve the EPR Effect in the tumor microenvironment[J].테라노틱스, 2019,9(26):8073-8090.
[23] 데쉬무크 A S, 차우한 P N, 놀비엠 N 등.고분자 micelles:basic research to clinical practice[J].Int J Pharm, 2017,532(1):249-268.
[24] JHAVERI A M, TORCHILIN V P. 약물 전달용 다기능 중합체 미셀 및 siRNA다 [J다] 프론트 파솔, 2014,5:77.
[25] 아흐마드 Z, 샤 A, 시디크 M 등.약물전달체로서의 중합미셀 [J.「 RSC Advances 」, 2014,4(33):17028-17038.
[26] SHARMA A, 리H J. Ginsenoside Compound K:insights into recent studies on pharmacokinetics and health-promoting activities[J] (영어).Biomolecules, 2020,10(7):1028.
[27] LI P, ZHOU X Y, QU D, 외.covalently conjugated celastrol-polyethylene glycol-ginsenoside Rh2의 자기조립 미셀의 제조, 특성 및 시너지 항폐암 효과에 관한 기초연구 (J.약물전달, 2017,24(1):834-845.
[28] 디아나 G, 아르투어 C P, 유제니안.약물전달시스템으로서의 리포좀의 설계 (Design of liposomes as drug delivery system for therapeutic applications)Int J Pharm, 2021,601:120571.
[29] DE L V, MILANO F,AGOSTIANOA 외.약물전달을 위한 고분자/리포좀 조립의 최근 발전:표면 수정에서 하이브리드 소포체까지 (Recent advancements in polymer/liposome assembly for drug delivery:from surface modification to hybrid vesicles)고분자, 2021,13(7):1027.
[30] 알메이다 B, 나그오 K, 로저스 K E 등.최근 리포좀 매개체 약물전달을 위한 바이오활용 전략의 진전 (Recent progress in bioconjugation strategies for liposome-mediated drug delivery)분자, 2020,25(23):5672.
[31] 구 Y, 왕 G J, 우 X L 외.ginsenoside Rh2의 장내 흡수기전:입체 선택성과 ABC transporters의 관여 [J].「 Xenobiotica 」, 2010,40(9):602-612.
[32] XU L Q, 유 H, 음양 S P, et al. Liposome-based delivery systems for ginsenoside Rh2: in vitro and in 생체 실험 비교다 [J다]J Nanopart Res, 2015,17(10):415.
[33] 하오 F, 헤이 X, 써니 T 등.sodium deoxycholate를 함유한 다량전달체계에 의한 인삼열매사포닌의 경구이용성 개선 (J.사우디 J Biol Sci, 2016,23(1):S113-S125.
[34] GROOT C D, MUSKEN M, MULLER-GOYMANN C C.의 bidesmosidic triterpene saponinshederacoside C와 ginsenoside Rb1은 지방막에서 콜레스테롤에 대한 낮은 친화력을 나타낸다 [J].J 약물 Deliv Sci Tec, 2019,53:101127.
[35] ANTON N, VANDAMME T F. Nano-emulsions and micro-emulsions:clarifications of the critical differences[J]. 「 나노에멀젼 」.Pharm Res, 2011,28(5):978-985.
[36] 맥클레멘츠 D J. 식용 나노 에멀젼의 발전:소화, 생체 가용성, 잠재적 독성 (J.Prog Lipid Res, 2021,81:101081.
[37] MASKARE R G, INDURWADE N H, DESHMUKH RA 등.나노 에뮬레이션:경구 약물 전달에서 가능성을 증가 [J].Asian J Chem Tec, 2021,11(1):53-58.
[38] SEGUY L, GROO A C, GOUX D 등.소수성 api의 정맥 투여를 위한 비용혈성 나노에멀젼의 설계 [J.제약학, 2020,12(12):1141.
[39] 바시르 M, 아마드 J, 아시프 M 외.Nanoemulgel, 심오한 항 염증 효과를 가진 diflunisal 국소 전달을위한 혁신적인 운반체:in vitro 및 in vivo 평가 [J].Int J Nanomed, 2021,16:1457-1472.
[40] HE C Y, FENG R, SUN Y P 등.에 의한 ginsenoside Rg1과 대사산물의 동시 정량 HPLC-MS/MS:쥐의 담즙, 소변 및 대변에서의 Rg1배설 [J].Acta Pharm Sin B, 2016,6(6):593-599.
[41] KHATTAB A, AHMED-FARID O A, NASR S A. Ginsenoside Rg1기반의 뇌 생체 분포를 향상시켰습니다 대사 증후군을 개선하고 항상성 균형을 유지하기 위해 자체 나노 유화 약물 전달 시스템.J 약물 Deliv Sci Tec, 2021,61:1002276.
[42] YHEE J Y, LEE J, CHANG H, et al. 분자 이미지 and 대상 drug delivery using albumin-based 나노 입자다 [J다]Curr Pharm Design, 2015,21(14):1889-1898.
[43] LIU Z B, CHEN X Y. Simple bioconjugate chemistry는 진단 및 정밀 치료를 위한 다용도 플랫폼으로서의 알부민이라는 큰 임상 발전에 이바지한다.「 Chem Soc Rev 」, 2016,45(5):1432-1456.
[44] 자인 A, 싱 S K, 아리아 S K 외.단백질 나노입자:약물 전달 응용을 위한 유망 플랫폼 [J].ACS Biomater Sci Eng, 2018,4(12):3939-3961.
[45] 장 L J, 후이 J F, 마 P 외.부제:PEGylation of ginsenoside Rg3-entrapped bovine serum albumin nanoparticles:preparation, characterization, and in vitro biological studies[J].J 나노머신, 2019:3959037.
[46] DONG YN, FU R Z, YANG J 외.엽산 변형 진세노사이드 rg5 탑재 소혈청 알부민 나노입자를 이용한 표적암치료 in vitro 및 in vivo[J.Int J Nanomed, 2019,14:6971-6988.
[47] RAI M, INGLE A P, GUPTA I, 외.바이오폴리머로 장식된 고상금속 나노입자의 생리활성 및 약물전달에의 응용 [J.Int J Pharm, 2015,496(2):159-172.
[48] GOKUL P, NAMITHARAN K, ARUL M R, et al. 비등 방성 고귀 한 금속 나노 입자: 합성, surface functionalization and applications in biosensing, bioimaging, drug delivery and theranostics[J]에 대한 자료입니다.Acta Biomater, 2017, 49:45-65.
[49] NOOR NA R, BASMA AA, NATHEER H A R 외.약물전달에서의 자성:철 산화물과 치환된 페라이트 나노입자의 경질 (J.Saudi Pharm J, 2020,28(7):876-887.
[50] 렌 Z G, 첸 X M, 홍 L J 외.ginsenoside Rg3의 나노입자 결합은 간세포암 발생 및 전이를 억제한다 [J.소형, 2020,16(2):e1905233.
[51] KIM YJ, PERUMALSAMY H, MARKUS J 외.ginsenoside compound K의 전달을 위한 Lactobacillus kimchicus dcy51t 매개 금 나노입자의 개발:in vitro photothermal effects and apoptosis detection in cancer cellArtif Cell, Nanomed, Biotechnol, 2019,47(1):30-44.
[52] 다이 L, 류 K F,시 C L 등.진세노사이드 나노입자:새로운 친환경 약물 전달 시스템 [J.J Mater Chem B, 2015,4(3):529-538.
[53] 조우제이, 르제이 Q, 장 B C 등.독특한 투과성을 가진 ginsenoside 나노입자에 의한 인슐린의 경피전달 가속화 [J.Int J Pharm, 2021,605:120784.
[54] 슈 G F, 칼리드 N, 첸 Z 외.천연유화제로 인삼 사포닌을 이용하여 안정화된 astaxanthin-enriched nanoemulsions의 제조 및 특성 (J.푸드켐, 2018,255:67-74.
[55] HONG C, LIANG J M, XIA J X, 외.일석네조:종양 표적치료를 위한 ginsenoside Rh2로 다기능화된 새로운 지방질 전달 시스템 [J.Nano-Micro Lett, 2020,12(10):73-90.
[56] ZHU Y, LIANG J M, 가 오 C F, et al. 다기능 ginsenoside Rg3-based liposomes 신경교종 표적치료 [J.J 제어 릴리스, 2020,330:641-657.
[57] RAMANI P, HEADFORD A, MAY M T. GLUT1단백질 발현은 신경성 종양 환자에서 비호의적 조직학적 범주 및 높은 위험성과 상관관계가 있다 [J].Virchows Arch, 2013,462:203-209 쪽.
[58] 첸 C, 샤아 J X, 렌 H W 외.진세노사이드의 구조가 그들의 리포솜의 생체내 운명에 미치는 영향 (Effect of the structure of ginsenosides on the in vivo fate of their liposomes[J])Asian J Pharm Sci, 2022, 2022,17(2):219-229.
[59] 왕이즈, 수 Q, 우 W 등.glucose transporter 1에 의한 ginsenoside Rb1의 Brain transport profiles: in vitro 및 in vivo[J.프론트 파솔, 2018, 9:398.
[60] 로사 M T M G, 실바 E K, 산토스 D T 등.바이오 계면활성제로 브라질 인삼 뿌리에서 추출한 수용액 추출물을 이용하여 초음파하여 annatto seed oil 미니 에멀젼을 얻음 [J.J Food Eng, 2016,168:68-78.


 영어
영어 프랑스
프랑스 스페인
스페인 러시아
러시아 한국
한국 일본
일본





