D 알룰로스 분말의 생산 방법은 무엇입니까?
1 d-알룰로스 개요
D Allulose is 한hexose 설탕그리고한C-3 epimer 의D-fructose. Due to its high sweetness, low energy content, unique physiological functions 그리고potential health benefits, D-allulose is considered to be 한new sweetener 와great potenti알다.It h로become 한research hotspot in 이field 의rare sugar biosynthesis worldwide. However, D-allulose is extremely rare in nature 그리고difficult to synthesize chemically. The biosynthetic method, 에the other hand, h로a simple procedure 그리고has made great breakthroughs in recent years. Therefore, the author reviews the recent research progress in the biosynthesis 의D-allulose, including the physicochemical properties, physiological functions, applications, in 생체 실험metabolism, 그리고enzymatic producti에of D-allulose, covering the sources, enzymatic properties, crystal structures, 촉매mechanisms, heterologous expression, and separati에and purificati에processes of the key enzymes involved.
1.1 물리화학적 특성과 d-알룰로오스의 원천
D-Allulose is a six-carbon sugar with a melting point of 96 °C, soluble in water, and a density of 1.35 g/cm3[1]. The sweetness D-allulose의is 70% 그of sucrose[2]. D-Allulose is a reducing sugar and can participate in browning 반응during heat treatment. The calorific value of D-allulose was measured to be 0.029 kJ/g in a rat experiment, which is 0.3% of the energy of sucrose, indicating that D-allulose has almost zero energy [3-4]. D-allulose is very rare in nature, and plant sources are extremely rare [5]. Small amounts of allulose have also been found in some bacteria [6], and D-allulose is not found in animals. allulose has not been found in animals. However, D-allulose is also found in various foods, such as fruit juice that has undergone long-term heating treatment, and the content of D-allulose in various foods is closely related to the sugar concentration, temperature and heating time during the 생산process [2, 7].
체내 D-allulose의 생리적 기능과 대사 1.2
The physiological functions of D-allulose를 포함한다:식이 d-과당 및 d-포도당의 흡수를 감소시키고 [8-9];인슐린 저항성 향상 [7, 10-11];항 비만 활성 [12-14];그리고 혈중 지질 [15]을 낮춘다.쥐에서 d-알룰로오스의 대사 경로에 대한 연구에 따르면:1) 장 내 d-알룰로오스의 수송은 포도당 수송체 5에 의해 매개되며, d-프락토스에 대한 친화도가 낮다 [16-18];2) d-알룰로스는 글루코스 관련 대사에 관여하지 않는다 [19];3) d-알룰로오스는 동물의 간에서 대사될 수 없으며, 따라서 간 에너지 생성을 촉진할 수 없다 [20].d-알룰로오스의 약 98%는 경구 또는 정맥 투여 후 소변과 분변의 형태로 체내에서 배출되며 [21]맹장 내 미생물의 작용에 의해 소량의 d-알룰로오스만이 단사슬지방산으로 분해된다.
d-알룰로스의 응용 1.3
d-알룰로스는 2011년 미국 FD한로부터 일반적으로 안전한 것으로 간주되는 (GRAS) 제품으로 승인되었으며 [4, 7] 식품 성분 및 건강 보조제로 허용된다.연구에 따르면 d-알룰로스의 최대 섭취량은 하루 체중 kg 당 0.55 g 이며,이 범위 내의 사람에게는 설사를 일으키지 않는다고 한다 [8-9].
D-Allulose has broad market potential in the food industry due to its low calorie content, high sweetness and strong reducing properties. For example, D-allulose can comprehensively improve the properties of egg white protein through the Maillard reaction, such as excellent gel strength, emulsifying stability, foaming properties and antioxidant activity [22-23]. D-allulose can also improve the quality of fermented milk products, regulating the strong sour taste of yogurt caused by overfermentation, but does not affect the probiotic activity of the fermentation strain and the probiotic health benefits it imparts to the fermented product [ 21]. In addition, the use of 25% D-allulose in baking, in combination with other additives, can produce sugar-free cakes [24].
d-알룰로스는 다른 분야에서도 광범위한 응용 가능성을 가지고 있습니다.예를 들어, d-알룰로오스 (d-알룰로오스)로 만든 식물성 소재는 영구적이고, 방수적이며, 환경친화적인 광소자 및 액정 디스플레이 [25]용 빛 전송 필름으로 사용될 수 있다.d-알룰로스는 또한 최초로 발견된 설탕 기반의 구충제이며, 기생충의 성장을 억제하는데 일부 긍정적인 효과가 있다 [26-27].또한 D-allulose는 다른 헥소스의 전구체이며 D-allose [28-29]의 생산에 대단히 중요한 역할을하고 D-allitol [30]은 대단히 중요한 역할을 한다.
2.생물학적 효소법 (Biological enzyme method)
화학synthesis method of D-allulose has common disadvantages that are difficult to overcome, such as difficulties in isolation, many by-products, and the generation of chemical waste. Therefore, the green and environmentally friendly biological enzyme production method has gradually received widespread attention worldwide.
2.1.1 DTEase 계열 효소의 공급원
d-타가토스 3-에피머라제 계열 (DTEases)은 C3위치에서 케토 단당류의 이성질화를 촉매하는 효소이며 [32]희귀당 생산을 위한 핵심 효소이기도하다.DTEase 계열의 효소로는 d-타가토스 3-에피머라제 (DTEases) [33], d-알룰로스 3-에피머라제 (DAEase) [35], 케토스 3-에피머라제 (ketose 3-에피머라제) [36] 가 있으며, 이들은 모두 d-과당을 d-알룰로스로 전환하는 촉매작용을 하는 공통된 특성을 가지고 있다.
유전자 암호화 DTEase는 클 로스cellulolyticum H10[37], Ruminococcus sp.[38], Clostridium scindens[34], Desmospora sp.[35]에서 순차적으로 분리되었으나, d-알를로스의 산업적 생산을 위해 더 많은 원천과 더 효율적인 DTEase[32, 37, 39-40]를 아직 탐색할 필요가 있다.
DTEase의 효소의 특성 2.1.2
DTEase 계열의 효소 중에서 D-allulose-3-epimerase(DTEase) 가 D-fructose의 D-allulose 반응을 촉매하는데 가장 높은 효율을 보인다.C. cellulolyticum과 A. tumefaciens에서 제조한 DAEases의 촉매효율 (Kcat/Km)은 각각 186.4, 205 L/(mmol·min)으로 Clostridium sp. (141.4 L/(mmol·min)) 및 Ruminococcus sp. (51 L/(mmol·min)) [34, 37-38], 표 1을 참조.
금속 이온은 d-과당과 결합하여 고정되며 d-과당이 d-알룰로스로 전환되는데 결정적인 역할을 한다.Asp183과 His209잔기는 금속 이온을 통해 기질을 효과적으로 결합한다.DTEase 계열의 효소들은 금속 이온인 Mn2+, Co2+, Mg2+ [41, 44-45]에 대한 의존성의 정도가 상당히 다르다.그러나 C. cellulolyticum 으로부터의 DAEase와 C. scindens 로부터의 DTEase의 효소활성은 금속이온인 Mn2+와 Co2+에 엄격히 의존한다 [35, 37].
DTEase의 결정 구조 2.1.3
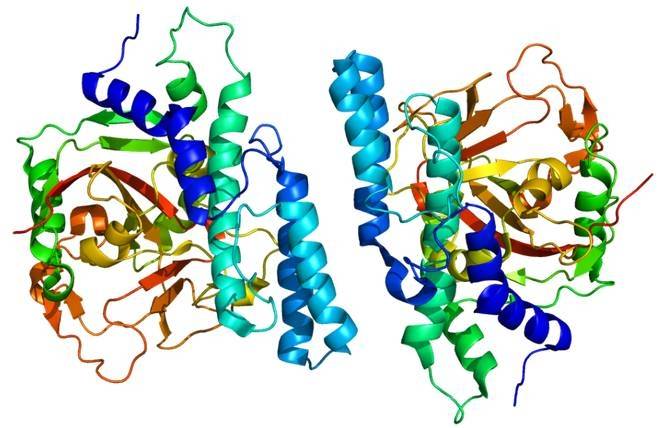
DTEase 계열 효소 중에서 A. tumefaciens와 C. cellulolyticum의 DAEases 가 테트라머와 가장 가까운 형태를 보인다.다이지 테트라머에서 두 소단위의 아미노산 잔기 사이에 34개의 수소 결합이 형성된다.DAEase의 높은 촉매 활성은 DTEase 계열 효소의 두 이량체 사이의 광범위한 상호작용에 의해 발생하는 넓은 계면 용매 접근 영역 (interfacial solvent-accessible area)에 기인한다 [42].또한, 재조합 균주에 의해 발현된 DAEase는 여전히 우수한 효소적 특성을 나타낸다.C. cellulolyticum H10에서 발현되는 다이즈의 이형 발현은 반감기가 더 길고, 운동 파라미터가 높으며 열 안정성이 높다 [37].
DAEase의 4차 배열은 4개의 동일한 소단위 A, B, C, d로 구성된 비대칭 단위이며 활성 부위는 금속 이온의 4잔기, 두 물 분자의 8 면체 조정 (octahedral coordination)을 포함한다.이 네 개의 소단위체는 소단위 A와 D 가 서로 상호작용하는 결정대칭 (dimers)에 관련된 것으로서, 소단위 B와 c에 모두 근접하여 다이지 (DAEase)의 활성부위가 다이머의 동일한 앞면에 노출되어 있다.이러한 안정적인 이량체는 이량체 (dimer)의 일면에 기판을 결합하기 위한 접근 가능한 우수한 표면을 제공한다 [16].
활성 부위의 소수성 홈과 접근 가능한 표면은 A와 B 하위 단위 사이에 위치합니다.DAEase의 하부 장치 측면은 닫혀 배럴 구조의 양 끝에 노출되어 있습니다.다이지 (DAEase)의 테트라머에서, 두 개의 다이머가 통 구조의 양 측면에 동봉되어 있다.각 모노 머 (아 단위 A, B, C와 D)으로 구성 된 8 단위 (β/α) 구조 물의 반복 합니다.각 량은 13 α로 이루어 져-helices과 8 명의 β-folds, 모노 머의 [16]의 주요 구조를 형성하다.
DTEase의 촉매 메커니즘 2.1.4
DTEase 계열 효소의 촉매 작용은 소단위의 분자 배열에 따라 달라진다.이들의 활성 부위는 효율적인 효소 반응을 얻기 위해 기질에 위치한다.Mn2+와 2개의 물분자와 4개의 아미노산 (Glu, Asp, His, Glu)은 팔면체 조화를 이루고,이 4개의 아미노산 잔기는 모든 ketose 3-epimerases에서 완전히 보존된다.A. tumefaciens의 DAEase와 P. cichorii의 DTEase에서 6가지 잔류물 (Glul50/Glul52, Aspl83/Aspl85, His209/His211, Glu244/Glu246, Glul56/Glu158, His185/His188)은 site-directed mutagenesis에서 기질결합과 열적 안정성에 중요하다.
기질이 물 분자를 대체한 후, 활성 부위는 이입체 이성화 과정을 거친다.두 잔기인 Glu50과 Glu244는 Mn2+와 협력하여 d-과당의 C3에 있는 양성자를 제거하여 d-알룰로스의 cis-diol 중간체를 형성하고, d-알룰로스는 다이즈 활성 부위의 수소 결합과 물 분자 사이의 위치에서 방출된다.

현재 촉매 활성과 열적 안정성을 향상시키기 위해 DTEase 계열의 효소에 대한 분자 개량이 수행되고 있다.D-allulose 생산시 Caldicellulosiruptor obsidiansis 로부터 L-rhamnose이성질체의 열안정성 및 촉매거동을 향상시키기 위해 Site-directed mutagenesis를 이용하였다.소수 성 β에 잔류 물을 1-α 1-loop 북극 아미노산과 함께 완전히 대체 될 수 있었다.야생형 효소와 비교하여 V48N/G59N/I63N과 V48N/G59N/I63N/F335S 돌연변이의 상대적 활성은 야생형 효소에 비해 각각 105.6%, 134.1% 높은 상대적 활성을 보인다 [57].또한 Site-directed mutagenesis는 Dorea sp. [50] 로부터 D-allulose-3-epimerase(DAEase)의 열 안정성을 향상시켰다.
DTEase 계열 효소의 촉매 메커니즘에 대한 연구는 아직 걸음마 단계이며, 효소구조와 촉매기능과의 관계에 대해서는 더욱 심층적인 연구가 필요하다.또한, DTEase의 열 안정성 및 기질 특이성은 아직 부족한 부분이 있습니다.희귀당 생산시 DTEase 계열 효소의 기질 특이성을 더욱 활용하여 기능성 희귀당의 효율적이고 친환경적인 생산을 달성해야 한다.
DTEase의 이형성 발현 2.1.5
대부분의 DTEase 계열 효소는 박테리아로부터 확인 및 분리되었으며, 자연 균주에서 발현되는 효소의 수는 응용 분야의 요구 사항을 충족시키기에는 턱없이 부족하다.따라서 발현벡터를 구성하여 이형생물에서 발현시키는 것은 특성화 연구와 효소학적 응용에 있어서 매우 중요하다.
Bacillus subtilis, Escherichia coli 그리고 효모는 DAEase 발현을 위한 재조합 시스템을 구성하는데 일반적으로 사용된다.대장균과 달리 Bacillus subtilis는 외막이 없기 때문에 분비하는 단백질을 배양액으로 바로 내보낼 수 있다.또한 Bacillus subtilis는 식품급이며 분비하는 단백질에서 heat-labile lipopolysaccharides (내독소)를 분비하지 않습니다.조작된 박테리아 대장균 (Escherichia coli, E. coli)은 명확한 유전적 배경, 완전한 벡터 수용체 시스템, 빠른 성장, 간단한 재배, 재조합 안정성 등의 장점을 가지고 있다.또한 효모발현 시스템은 배양조건이 간단하고 생장이 빠르며 발현 수준이 높고 조작이 간단한 특징을 가지고 있다.번역이 끝나면 단백질을 가공해 정확하게 변형할 수 있다.효모 발현 시스템의 단점은 낮은 복제 유전자 발현, 긴 발효 시간, 잘못된 단백질 당화, 세포 분열에 대한 저항성이다.또한, 초산물의 다당류 농도가 높으면 재조합 단백질의 정제에 도움이 되지 않는다.
초기 연구자들은 DTEase 계열 효소의 발현과 효소학을 연구하기 위해 대장균을 숙주 세균으로 사용하는 경향이 있었다 [34, 37].최근 많은 연구자들이 D-allulose의 생산을 위해 DTEase 계열의 효소를 발현시키기 위해 Bacillus subtilis와 효모를 숙주 세균으로 사용하고 있다 [35].A. tumefaciens의 DAEase 유전자는 재조합 후 E. coli와 K. marxianus에서 발현되어 알룰로스 생산에 사용되었으며, D-allulose의 생산량은 각각 230 g/L [53], 190 g/L [56]에 달했다.비교적으로 대장균 발현 시스템을 이용하여 A. tumefaciens에서 발현된 다ease 효소가 현재까지 가장 높은 발현 수준을 보였으며, 표 2에 나타낸 바와 같다.
(1) 대장균 발현 시스템:대장균 발현 시스템은 비용이 저렴하고 발현 효율이 높은 장점이 있습니다.DTEase 계열의 효소는 수용성 단백질로서 대장균에서 과발현 될 수 있다.재조합 DTEase 효소를 친화성 크로마토그래피를 이용하여 분리 및 정제하고, d-알룰로오스의 수율은 120-218 g/L 이며, 전환율은 24~33%이다 [34].Agrobacterium tumefaciens 로부터 전세포 반응법을 이용한 재조합 대장균에서 발현된 다ease 효소의 수율과 전환효율은 각각 230 g/L 및 33%였다 [53].
(2) 바실러스 발현 시스템:다이지 코딩 유전자를 가지고 있는 재조합 바실러스 서브틸리스 (Bacillus subtilis)는 다이지 효소를 고효율 저비용 방식으로 과발현 시킬 수 있다.음이온 교환수지 매트릭스에 고정화된 재조합 다이지 (DAEase)는 안정적이고 효율적인 알룰로오스 생산을 촉진할 수 있다.Bacillus subtilis B. subtilis에서 발현된 재조합 DAEase는 58.6 U/mg의 활성을 나타내어 대장균 (8.95 U/mg)보다 높은 활성을 나타내었다.또한 다이지 발현의 조절 요소는 효소의 양과 활성에도 영향을 미친다.Bacillus subtilis B. subtilis에서 벡터인 pma5-pxy/A-RDPE는 95 U/mL의 효소활성으로 DAEase를 안정적으로 발현할 수 있다.이 값은 pBluescript-SK-DTE vector를 가진 대장균 E. coli에서 발현되는 효소 활성보다 높다 [54].
3) 효모 발현 시스템:
The exogenous DAEase gene can be highly expressed in recombinant S. cerevisiae [55] and Kluyveromycesmarxianus[56]. The expression vector pRS424-TEFpr-ss-xy/A, which carries the DAEase gene 에서A. tumefaciens, can express a protein with a relative molecular mass of 33 000 in S. cerevisiae AN120 [55]. The xylose isomerasegene 에서T. thermophilus and the DAEase gene 에서A. tumefaciens are co-expressed in yeast spores to enhance synergistic catalysis. The two recombinant enzymes were immobilized and D-allulose was produced 사용D-glucose as the substrate [55]. The recombinant xylose isomerase catalyzes the conversion of D-glucose to D-fructose, and the recombinant DAEase converts D-fructose to D-allulose. Yang et 알다.provided a valuable approach to regenerate modified K. marxianus cells, which can produce D-allulose in a recycling catalytic manner [56]. The recombinant K. marxianus produced 190 g/L D-allulose from a substrate concentration of 750 g/L D-fructose within 12 h, and about 100 g of residual D-fructose was converted by the engineered bacteria into 34 g of ethanol. In addition, the idea of producing D-allulose by whole-cell bio촉매작용has also been proposed [56].
d-알룰로스의 분리 및 정제2.2
The separation and purification of D-allulose mainly includes the following two methods: The first method is ion exchange resin. Anion exchange resin matrix and simultaneous moving bed chromatography were used to immobilize DAEase enzyme to produce D-allulose from D-fructose as a substrate. Using ion exchange resin dialysis, R. sphaeroides SK011 세포can produce 6.5 g/L D-allulose from an initial substrate concentration of 50 g/L D-fructose [39], with a production rate of 0.82 g·h-1. For a mixed system containing D-allulose and D- fructose, D-allulose was first converted to gluconic acid and then purified to 91.2% by anion exchange resin [57].
두 번째 방법은 생물학적 방법을 이용하여 d-알룰로오스를 정제한다.d-알룰로스와 d-과당을 포함하는 혼합계에서 효모를 이용하여 남은 d-과당을 섭취하고 에탄올을 제조하여 d-알룰로스를 얻었다.또한, 삼투압 증발, 케이션 교환 크로마토그래피 및 생물학적 방법을 병행하여 d-알룰로스를 분리 및 정제하였으며, 순도는 최대 86.2% [58]였다.
3 토론
D-Allulose는 D-fructose의 C-3 epimer로 많은 생리적 기능을 가지고 있으며 식품, 의약품 및 건강 관리에 널리 사용됩니다.미국 FDA 가 2019년 4월 알룰로스를 첨가당 및 총당 집계에서 제외하는 우대조치를 통과시킨 이후 주요 기업들이 알룰로스에 큰 관심을 갖기 시작했다.현재, the world's는 D-allulose의 주요 생산업체로, South Korea's CJ CheilJedang, the UK's 테이트 &Lyle과 Japan's Matsutani 군, 모두 생물학적 방법을 사용하여 d-알룰로스를 생성한다.따라서 d-알룰로스의 생산을 촉매할 수 있는 유전자 조작 박테리아의 제조는 d-알룰로스의 산업화를 위한 중요한 토대가 된다.비록 알룰로오스는 현재 몇몇 국가에서만 합법적으로 사용될 수 있지만, 의심할 여지 없이 미래에 주요 감미료가 될 것이다.
Although there have been major breakthroughs in the research of the biological enzyme method 을D-allulose, in particular the rapid development of gene mining and cell construction technology, the industrial prospects 을the biological production of D-allulose remain uncertain. Subsequent research can be carried out in the following two areas: 1) screening DTEase family enzymes with high activity and stability through gene mining methods, establishing efficient high-throughput screening methods, and molecularly modifying DTEase family enzymes to better meet the needs of industrialization, thereby achieving efficient conversion of D-fructose and D-allulose; 2) since the industrial preparation of D-allulose faces the problem of removal of residual D-fructose in the mixture after enzymatic catalysis, the separation and purification of D-allulose increases its production cost. At present, there are relatively few studies on the separation and purification and crystallization of D-allulose, indicating that downstream industrialization is relatively lagging behind. It is necessary to further reduce the industrial production cost of D-allulose and improve the production efficiency of D-allulose by simplifying downstream process steps, such as separation and purification, crystallization, drying and other process steps.
그림 1은 D-allulose [16]에 대해보다 진보된 친환경 및 재활용 가능한 공정 기술을 보여준다.전체 반응계는 생물반응기 A (자크로스 가수분해 및 d-알룰로오스로의 효소전환을 위해)와 생물반응기 B (에탄올 생산, d-알룰로오스 분리 및 효모 전파를 위해)로 나뉜다.원사탕수수즙이나 단수수즙은 자당을 생산하는 원료로 사용된다.사용된 조작효모에는 천연 수크로스 이성화효소와 재조합 외인성 DTEase 계열 효소 유전자가 포함되어 있어 조작효모는 수크로스를 수크로스 이성화효소로 가수분해함으로써 d-포도당과 d-과당을 생산할 수 있다.d-과당은 55~60 °C에서 DTEase 계열 효소에 의해 d-알룰로스로 전환되고, 남은 d-포도당과 d-과당은 27~30 °C에서 발효되어 에탄올을 생성하고, 에탄올을 모아 연료로 사용할 수 있다.이 방법의 장점은 낮은 원료 비용, 가능한 한 공정 중에 생성되는 중간 제품 사용, 번거로운 분리 및 정화 단계의 감소뿐만 아니라 폐기물 형성의 감소, 낮은 에너지 소비 및 높은 당 수율입니다.
4 전망
현재 D-allulose는 산업적으로 중국, 일본, 한국, 미국 및 영국에서 톤 수준에서 생산되고 있다.치열한 산업 경쟁에서 두각을 나타내기 위해서는 d-알룰로스를 생산하는 기업들이 공정에서 각 링크의 기술을 향상시켜야 한다.현재 주요 생산 장벽은 이성질체의 낮은 활동성과 낮은 전환율, 낮은 재사용 빈도이다.따라서 효소 활성, 안정성 및 촉매 효율을 향상시키는 것이 향후 DTEase 계열 효소의 연구 및 개발의 핵심 목표가 되어야 합니다.d-알를로오스의 생산 비용은 탈색, 담수, 결정화 및 건조 공정을 개선하여 절감 할 수 있습니다.효율적인 high-throughput screening 기술을 이용한 비합리적인 공정의 합리적 설계 또는 수정은 DTEase 계열 효소의 구조를 변화시키는 직접적인 방법이다.DTEase 계열의 효소를 개선하고 생산 공정을 개선함으로써 d-알룰로오스의 생산 비용을 절감하고 가격을 낮출 수 있어 d-알룰로오스가 소비자에게 쉽게 공급될 수 있도록 보장합니다.
참조
[1] FUKADA K,ISHII T,TANAKA K 등 희귀 단당류 D-psicose[J]의 결정구조, 용해도 및 mutarotation.Bulletin of the Chemical Society of Japan,2010,84(6):678-678.
[2] OSHIMAH,KIMURA I,IZUMORI K. Psicosecontents in various food products and its origin[J.식품과학기술연구,2006,12(2):137-143.
[3] MATSUO T,SUZUKI H,HASHIGUCHI M,et 알다.D-psicose는 자라나는 쥐에게 에너지를 공급하지 않는 아라레 당이다 [J].한국영양학 · 비타민학회지,2002,48(1):77-80.
[4] 무 W, 장 W, 풍 Y 등 최근 D-psicose[J]의 응용 및 생명공학 생산에 대한 진보가 있다.한국미생물학회지 Applied Microbiology and Biotechnology,2012,94(6):1461-1467.
[5] Benjamin J Ayers,Jacqueline Hollinshead,Alexander W Saville,et 알다.Iteamine, Iteavirginica L.에서 분리 된 최초의 알칼로이드, florescence[J].2014년 Phytochemistry, 100 (2):126-131다.
[6 ] 장 L, 무 W, 장 B 외 특성화 D-fructose를 D-psicose로 전환시키는 Rhodobacter sphaeroides 로부터 D-tagatose-3-epimerase의 [J.2009년 생명공학 편지, 31:857-862다.
[7] 장 W, 유 S,장T 등 최근 D-allulose의 발전:생리적 기능, 응용, 생물학적 생산 [J.식품과학기술동향,2016,54(54):127-137.
[8] HOSSAINA,YAMAGUCHI F,HIROSE K,et 알다.희귀당 D-psicose는 T2DM 모델 Otsuka Long-Evans Tokushima 지방쥐 [J]에서 당뇨병의 진행과 발생을 예방한다.약물설계, 개발 및 치료,2015,9:525-535.
[9 ] HOSSAIN A, 야마구치 F, 가 쓴 T, et 알다. 희귀 한 sugar D-allulose:잠재적인 역할 and 치료 모니터링 비만과 제2 형 당뇨병을 유지하는데 있어.키로 결정 &2015년에 게재, 155:49-59다.
[10] HOSSAIN M A,KITAGAKI S,NAKANO D,et 알다.희귀당 D-psicose는 제2 형 당뇨병 Otsuka Long-Evans Tokushima Fatty(OLETF) 쥐에서 인슐린 민감성과 내당성을 향상시킨다 [J].「 Biochemical and Biophysical Research Communica-tions 」,2011,405(1):7-12.
[11] OCHIAI M,NAKANISHI Y,YAMADA T 등은 high-자당식이를 섭취한 성체 쥐에서 체지방 축적의 식이성 D-psicose에 의한 억제 (J.바이오 과학 Biotechnology &2013년 생화학, 77 (5):1123-1126.
[12] CHUNG Y M,LEE J H,KIM D Y 등은 고지방 식이유발 비만쥐에서 D-psicose가 내장지방량을 감소시켰다.한국식품과학회지 2012,77(2):H53-H58.
[13] CHUNG MY,OH DK,LEE KW. Hypoglycemic health benefits of D-psicose[J.한국농식품화학학회지, 2012,60(4):863-869.
[14] IIDA T,YAMADA T,HAYASHI N, 외 액상과당으로 만든 새로 개발된 감미료를 8주간 섭취함으로써 쥐의 복부지방 축적 감소 [J].2013년 음식 화학, 138 (2-3):781-785다.
[15] OCHIAI M,ONISHI K,YAMADA T,et 알다.D-psicose는 ahigh-sucrose 식이를 섭취한 쥐에서 에너지 지출을 증가시키고 체지방 축적을 감소시킨다 [J].한국식품영양과학회지 2014,65(2):245-250.
[16] 지 앙 S, 샤 오 W, ZHU X, et 알다. 검토 on d-allulose: vivo 신진대사, 촉매 메커니즘, 공학 균주 건설, 바이오 생산 기술 [J.한국생명공학교육학회 학술대회 2020년, Frontiers in Bioengineering and Biotechnology,2020,8:26.
[17] 뛰어 G, 선 탠을 D, 자 오 J, et 알다. Functionalized polyhydroxyalkanoatenano-beads as a 안정 된 biocatalyst for 희귀한 설탕 d-알룰로스의 비용 효율적인 생산.구라 기술, 2019년, 289:9-18다.
[18] KISHIDA K,MARTINEZ G,IIDA T,et 알다.d-알룰로오스 (D-allulose)는 소장에서 포도당 수송체 타입 5(GLUT5)의 기질이다 [J].음식 화학, 2019년, 277:604-608다.
[19] IWASAKI Y,SENDO M,DEZAKI K,et 알다.GLP-1 방출 및 vagal afferent 활성화는 D-allulose의 유익한 대사 및 시간 치료 효과를 중재한다 [J].자연 통신, 2018년 9:17-25다.
[20] MAENG H J,YOON J H,CHUN K M 등, biorelevant media 및 hepatocytes에서 D-allulose의 대사 안정성:comparison with fructose and erythritol[J].음식, 2019년, 8:13-18다.
[21] 키모토-니라 H, 모리야 N, 하야카와 S, et 알다. rare의 효과 설탕 D-allulose on 산성 생산 및 유제품 젖산균의 probiotic activity [J.한국낙농학회지 2017,100(7):5936-5944.
[22] O'CHAROEN S,HAYAKAWA S,OGAWA M.Food properties of egg white protein modified by rare ketohexoses through maillard reaction[J].국제학술지 한국식품과학&기술, 2015년, 50 (1):194-202다.
[23] 얀 Z, 장 H, GUAN Y, et al. D-psicose의 영향에 대한 비교 연구와 maillard의 반응에 d-fructose β-lactoglobulin다 [J다]식품과학과 생명공학,2013,22(2):341-346.
[24] LEE P,OH H,KIM S Y, et al. 효과 of D-allulose as a sucrose 대체 on the 부지의 구조, 그리고 파운드케이크의 감각적 특성 [J.식품가공보존학회지 2020,44(6),e14472.
[25] 타 케이 S, HANABATA M. 친 환경, 발 수제, light-transparent 영화 파생 된 from psicose 사용 nanoimprint 고분다 [J다]2015년 재료 편지, 143:197-200다.
[26] HARADA M,KONDO E,HAYASHI H,et al. D-allose와 D-psicose는 트리코모나드 [J]에 메트로니다졸의 작용을 강화한다.2012년 Parasitology 연구, 110 (4):1565-1567.
[27] 사토 M, KUROSE H, YAMASAKI T, et al. 잠재적인 anthelmintic:D-psicose 억제 운동성, 성장 and 예쁜꼬마선충 L1 유충의 생식 성숙 (J.한국천연물의약품학회지,2008,62(2):244-246.
[28] FENG Z,MUW,JIANG B. Thermotoga lettingae TMO[J] 로부터 D-psicose를 d-알로스로 전환시키는 리보스-5-인산이성질체 효소의 특성.2013년 생명공학 편지, 35:719-724다.
[29] YEOM S J,SEO E S,KIM Y S 등은 Clostridium thermocellum (J) 으로부터 ribose-5-phosphate isomerase의 R132E 돌연변이에 의해 D-allose 생산을 증가시켰다.「 Applied Microbiology and Biotechnology 」,2011,89(6):1859-1866.
[30] HAN W,ZHU Y,MEN Y, 등은 Klebsiella oxytoca G4A4의 새로운 분리한 균주에 의해 D-psicose로부터 allitol을 생산 [J.기초미생물학회지,2014,54(10):1073-1079.
[31] SOENGAS R, IZUMORI K, 시몬 MI, et al. Kiliani reactions on ketoses:진출 탄수화물 건물 블록 d-tagatose와 D-psicose[J] 로부터.46, 2005년 Tetrahedron 편지 (34):5755-5759다.
[32] 지아 M, 무왕 W, 추 F, et al. A D-psicose 3-epimerase with 중립 pH 최적 from Clostridium bolteae for D-psicoseproduction:복제, 발현, 정화 및 특성 [J].한국미생물학회지 (Applied Microbiology and Biotechnology),2014, 98(2):717-725.
[33] 장 L, 무 W, 장 B, d-타가토스 3-에피머화 특성 Rhodobacter sphaeroides의 that D-fructose를 D-psicose[J]로 전환한다.2009년 생명공학 편지, 31일 (6):857-862다.
[34] 무 W, 장 W, 방 D 등은 Clostridium sp.[J] 로부터 D-psicose-producing enzyme인 D-psicose3-epimerase의 특성.2013년 생명공학 편지, 35 (9):1481-1486.
[35] ZHANG W,FANG D,XING Q, 등의 새로운 금속 의존성 D-psicose 3-epimerase의 특성 클로스트리디움 신덴스 35704[J].2013년 Plos One, 8, e62987.
[36] YOSHIDA H,YOSHIHARA A,SUZUKI T,et al.의 Xray structure of A novel ketose 3-epimerase from Shinella zoogloeods which can D-allulose production[J].FEBS Open Biol,2019,9:257-265.
[37] MU W, 추 F, 싱 Q, et al. 복제, 표현, 그리고 성격 묘사 of a D-psicose 3-epimerase from 클로스트리듐 셀룰로리티움 H10[J].한국농식품화학학회지,2011,59(14):7785-7792.
[38] ZHU Y,MEN Y,BAI W 등은 Ruminococcus에서 D-psicose 3-epimerase를 과발현 Escherichia coli에서 sp 그리고 D-psicose 생산에 적용 가능성 [J].2012년 생명공학 편지, 34 (10):1901-1906.
[39] ZHANG L, 장, B, 무왕 W, et al. Bioproduction D-psicose의 using permeabilized cells 새로 격리된 Rhodobacter sphaeroides SK011[J]입니다.「 중국화학공학의 프론티어 」,2009,3(4):393-398.
[40] 박 C, 김 T, 홍 S 등은 D-allulose 3-epimerase Flavonifractor plautii를 발현하는 코리네박테리움 글루타슘 세포의 투과성 재조합 세포에 의해 d-과당으로부터 D-allulose 생산 (J.Plos One, 2016년, (7) 11개, e0160044다.
[41] YANG J,TIAN C,ZHANG T 등, Corynebacterium glutamicum에서 tandem isoenzyme 유전자를 이용한 d-알룰로오스 3-epimerase 제조를 위한 식품급 발현 시스템 개발 및 사탕수수 당밀의 d-알룰로오스 전환에의 응용 (J.
『 생명공학과 생명공학 』,2019,116(4):745-756.
[42] LI S,첸Z,ZHANG W,et al. Caballeronia fortuita에서 d-타가토스 3-epimerase의 특성 및 희귀 설탕 생산에 응용.International Journal of Biological macromolecule,2019년,138:536-545.
[43] 주즈,리 C, 류 X 등의 생화학적 특성 및 생물촉매 응용 소설 D-tagatose 3-epimerase from Sinorhizobium sp.[J.RSC 발전, 2019년, 9 (6):2919-2927.
[44] ZHU Z,GAO D,LI C,et al.은 황색포도상구균으로부터 새로운 D-allulose 3-epimerase의 재설계 d-알룰로스의 온도 안정성 및 효율적인 생체 촉매 생산을 위해 [J.미생물세포공장,2019,18(1):1-10.
[45] TSENG W,첸C,HSU C,et. Agrobacterium sp. ATCC 로부터 재조합 d-allulose 3-epimerase의 특성
31749 및 중요한 계면 잔류물의 확인 [J].한국생물대분자학회지 2018년, International Journal of Biological macromolecule, 112:767-774
[46] YOSHIHARA A,KOZAKAI T,SHINTANI T 등 GRAS 미생물인 Arthrobacter globiformis M30 으로부터 추출한 D-allulose 3-epimerase의 정제 및 특성 (J.한국생물공학회 학술발표논문집 2017년, 제2017권 123(2):170-176.
[47] HE W,JIANG B,MU W 등은 Bacillus subtilis 포자의 표면에 발현되어 표시되는 D-psicose 3-epimerase를 이용한 D-allulose 생산 (J.한국농식품화학학회지 2016,64(38):7201-7207.
[48] 장 W, 장 T, 장 B 등의 Treponema 프리미티아자-1로부터 D-psicose 3-epimerase의 생화학적 특성 및 D-psicose의 효소적 생산에 대한 응용 [J.한국식품영양과학회 학술대회발표집 2016년, 제96(1):49-56.
[49] ZHANG W,LI H,ZHANG T, 등의 D-psicose 3-epimerase의 특성 Dorea sp. CAG317은 산성 pH 최적치와 높은 특이활성 [J.한국분자촉매학회 학술발표 논문집 2015년,2015년도 Molecular Catalysis B-Enzymatic 추계학술대회,120:68-74.
[50] 장 W, 장 Y, 황 J 등은 인터페이스 영역에서 site-directed mutagenesis에 의한 Dorea sp. CAG317로부터 d-Allulose 3-epimerase의 온도 안정성 향상.한국농식품화학학회 학술발표논문집 2018년,2018년도 한국농식품화학학회 추계학술대회, 665~593-5601.
[51] PATEL S N,KAUSHAL G,SINGH S. thermal aquatic habitat의 metagenome 으로부터 새로운 d-알룰로스 3-epimerase 유전자의 특성 및 Bacillus subtilis whole-cell catalysis에 의한 d-알룰로스 생산 [J.한국미생물학회지 2019년, Applied and Environmental Mic-robiology, 1:1-8.
[52] CHEN Z, 첸 J, 장 W, et al. 개선 thermostability and catalytic 행동 of L-rhamnose isomerase Caldicellulosiruptor obsidiansis OB47에서 site-directed mutagenesis에 의한 d-allulose를 향하여 [J.『 한국농식품학회지 』 화학, 2018년 66 (45):12017-12024다.
[53] 박 C, 박 C, 신 K 등은 Agrobacterium tumefaciens (J) 로부터 높은 수준의 D-psicose 3-epimerase를 발현한 전체 재조합 세포에 의한 d-fructose 로부터 D-psicose 생산.한국생물공학회 학술발표논문집 2016년,121(2):186- 190.
[54] CHEN J, ZHU Y, 푸 G, et al. 고위급 -간 and extra-cellular production of D-psicose 3-epimerase 을 통해 a modified xylose-inducible expression system in Bacillus subtilis[J.산업미생물&생명공학, 2016년, 43 (11):1577-1591.
[55] LI Z,LI Y,DUAN S 등은 Saccharomyces cerevisiaespores에 고정화된 d-xylose isomerase와 d-psicose 3-epimerase를 이용하여 d-glucose를 d-psicose로 생물전환하였다 [J].산업미생물&2015년 생명공학, 42 (8):1117-1128.
[56] 양 P, 주 X, 정 Z, 외 al. 셀 재생 and 반복 catalysis 의 설계 Kluyveromyces marxianus 한 D-allulose 생산을 위한 Agrobacterium tumefaciens의 d-psicose-3-epimerase 유전자 [J.세계미생물학회지 (World Journal of Microbiology) & 생명공학, 2018년, 34 (5):7-13.
[57]리 C, 장 C,린 J 등 D-psicose 바이오 생산 모델 용액에서 효소과당 제거 및 시스템 모델링 및 시뮬레이션 (J.한국화학학회지&생명공학, 2018년 93 (5):1249-1260.
[58] SONG Y,NGUYEN QA,WI SG, 외 십자화과 식물성 잔류물로부터 부가가치 생산물로서 바이오에탄올과 D-psicose의 이중 생산 전략 (J.구라 기술, 2017년, 223:34-39다.
[59] HE X,ZHOU X,YANG Z 등은 Escherichia coli JM109[J]에서 d-타가토스 3-epimerase 유전자의 클로닝, 발현 및 정제.단백질 발현&2015년 정화, 114:77-81다.
[60]리 C,린 J, 궈 Q, 외 D-psicose 3-epimerase 분비 과발현, 고정화, D-psicose 생물 전환, 분리 및 결정화 [J].한국화학학회지&생명공학, 2018년 93 (2):350-357다.


 영어
영어 프랑스
프랑스 스페인
스페인 러시아
러시아 한국
한국 일본
일본




