Mogroside V의 바이오 합성에 관한 연구
Sweeteners are 한type 의food additive. They c한될divided in을합성감미료그리고자연sweeteners according 을their source. Natural sweeteners can be further divided in을saccharides 그리고non-saccharides according 을their chemical structure 그리고properties. Recent studies have pointed out that 합성sweeteners can lead to intestinal flor한imbalance 그리고포도당intolerance, causing metabolic disorders[1], 그리고have become 한new type 의pollutant causing environmental pollution[2]; while 이high intake 의설탕contributes to 이occurrence 의치과caries, obesity, diabetes, metabolic syndrome 그리고cardiovascular disease[3-5]. Natural non-설탕substances 의plant orig에서have attracted increasing attenti에로a new generati에의sweeteners that can satisfy sweetcravings due to their high sweetness [6], low calories [7], 안전[8], 그리고lack 의cariogenicity [9].
현재, main자연non-sugar sweeteners that have been developed 그리고utilized at home 그리고abroad are: Thaumatin, steviol glycosides, Mogrosi드(Mogrosides) 그리고glycyrrhizicacid[6](Table 1), among which 이sweetest 은Thaumatin, but it exhibits a bitter taste 그리고이“off-flavor” 의liquorice, 그리고가이disadvantages 의delayed sweetness 그리고an excessively long durati에[17]; the second 은monk fruit sweetener, which has no unpleasant aftertaste 그리고is the only all-자연감미료that can reduce fat [14]. Mogroside V(M5) is the ma에서원본의sweetness 의Mogroside [18]. At a concentration 의1/10,000, its sweetness value is 425 times that 의5% sucrose [19]. It also has many 약리 학적activities, such as relieving coughs 그리고phlegm [20], anti-암[21-22], anti-oxidation [23], 그리고many other pharmacological activities, making it a new generation 의functional sweeteners that are being developed around the world. Due to the many difficulties 관련 된에서cultivating Luo 한강궈[25], 그리고the fact that the content 의M5 에서the whole fruit is only 0.8%–1.3% (W/W) [26], it is difficult to purify the complex 제품의its analogues, and it is impossible to achieve large-scale 생산에 의해relying on extraction 에서Luo 한강Guo.

식물 세포 배양 [27], 대사 공학 [28], 합성 생물학 [29]의 발전은 천연 식물 산물의 획득을 위한 지속 가능한 생산 아이디어를 제공했다.식물세포배양은 원가가 높고 시간이 오래 걸리며 생산량이 적어 특수한 천연물을 생산하는데 사용하기 어렵다.또한, 식물 세포의 복잡성과 유전적 도구 및 적절한 방법의 부족으로 인해 식물 세포의 대사 공학은 여러 단계의 생합성 경로를 필요로 하는 복잡한 천연 생성물 M5의 생산에 어려움을 겪고 있다 [30].따라서 식물세포배양 및 대사공학은 M5의 대규모 생산에 실행 가능한 방법이 아닐 수 있다.합성 생물학 (合成物學, 영어:Synthetic biology)은 최근 생명 시스템 및 과정 [31]을 재설계, 엔지니어링, 구성, 적용하기 위해 등장한 과학이다.
전통적인 방법과 비교해 주기가 짧고 생산량이 높으며 안전성과 오염이 없고 추출 공정이 간단한 장점이 있다.친환경적이고 효율적인 새로운 생산 모델이다.합성 생물학 연구의 지속적인 발전과 Luo 한강궈[32]의 mogrosides의 분자 생합성 메커니즘에 대한 심층적인 이해로, M5를 합성하기 위해 미생물을 사용하는 것은 대규모 생산의 새로운 방법이되었으며, 이는 천연 감미료에 대한 소비자 수요를 충족하는 데 있어 매우 중요하고 넓은 전망입니다.본 논문은 M5의 생합성 메커니즘과 합성생물학 연구 진행 과정을 살펴보고, 미생물 합성에서 직면하는 어려움에 대해 논의함으로써, M5의 생합성 연구에 참고자료를 제공하는 것을 목적으로 한다.
Mogroside V의 구조 및 약리 학적 활성 1
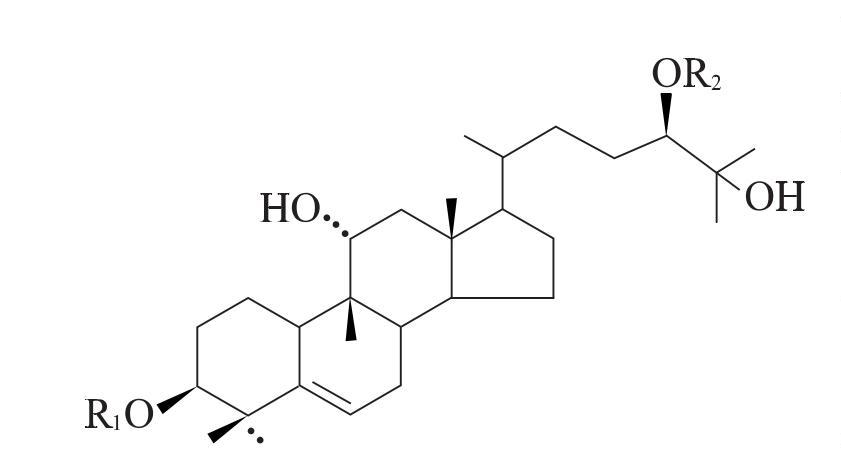
Siraitiagrosvenorii is the ripe fruit 의the Siraitiagrosvenoriiplant 에서the Cucurbitaceae family. It is used as a common traditional 중국 의학에서China [33]을its effects 의moistening the lungs to relieve coughs, cooling the blood, and moistening the bowels to promote bowel movements. Its ma에서active ingredient is the sweetglycoside [34]. Researchers [19,35–36] have isolated and identified a variety 의sweetglycosidesSiraitia에서grosvenorii, the basic structure 의which is shown 에서Figure 1. 이number 의glucose units and the way they are connected produce 감미료molecules 와significantly different tastes: the disaccharide sweetener IIE tastes extremely bitter, while the pentasaccharide M5 tastes extremely sweet[37].
M5는 Luo Han Guo 감미료의 성분으로 단맛과 함량이 가장 높다 [38].다케모토 츠네마츠 (Takemoto tsuematsu) [39-41]와 같은 일본 학자들에 의해 처음으로 분리되었으며, 아글리콘의 구조는 분광학적 방법으로 tetracyclic triterpenemomordinol로 확인됨으로써 M5의 완전한 구조를 구축하였다.M5의 분자식은 C60H102O29 이며, 이는 C3와 C24위치에서 momordinol에 포도당 단위를 첨가하여 형성된다.R2는 두 pyranose 단위로 연결 되어 한 마리의 β-1, 6-glycosidic 본드, R1은 진출 3-glucopyranosyl 그룹 β-1로 연결, 6-glycosidic 채권과 β-1, 2-glycosidic 채권이다.
식물 유래의 천연 무당 감미료는 종종 여러 가지 약리학적 활성을 나타낸다 (표 1). M5는 기침과 가래를 완화시키고, 항암, 산화 방지, 혈당을 조절하는 등 많은 기능을 가지고 있다.연구 결과 기침을 완화시키는 뤄한구오의 활성 성분은 부피 기준으로 50% 알코올 추출물이며, 분리된 M5는 쥐의 기침 횟수를 현저히 줄이고, 기침 대기 기간을 연장시키며, 기관지 내 페놀레드의 배출을 현저히 증가시켜 일정한 거담 효과를 나타내는 것으로 나타났다 [20].M5는 여러 생물학적 표적을 표적으로 하여 췌장암 세포의 증식과 생존을 억제할 수 있으며 [21], 이는 췌장암 이종이식물의 생쥐 모델에서 확인되었다.7,12-dimethylbenz[a]anthracene (DMBA), 12-O-tetradecanoylphorbol-13-acetate (TPA) 및 peroxynitrous 산(ONOO-)는 정상 세포의 종양 세포로의 전환을 유도하는 발암 물질입니다.M5는 쥐의 피부 발암실험에서 발암물질을 길항시켜 정상세포가 피부암세포로 변하는 속도를 늦추는 것으로 밝혀졌는데 [22], M5가 화학적 발암물질로 인한 피부암을 예방하는 효과가 있다는 것이다.M5 및 11-o-모그로사이드 V는 반응성 산소 종 (O2-·, H2O2 및 ·OH)을 현저히 제거하고 산화적 DN한손상을 억제할 수 있습니다.반면 11-o-모그로사이드 V는 M5보다 O2-· 및 H2O2에 대한 청소효과가 높지만, M5가 ·OH에 대한 청소효과가 더 좋다 [23].M5가 인슐린종 세포인 RIN-5F에서 인슐린 분비를 유도할 수 있다는 것을 발견하여 당뇨병 환자의 세포수준에 대한 M5의 혈당 조절 효과를 밝혔다.이 연구는 Luo Han Guo 추출물, 특히 M5가 제2 형 당뇨병 [24]을 예방하고 치료할 수 있는 가능성을 시사한다.
2. Mogroside V의 생합성 메커니즘 연구
합성생물학은 미생물 세포 [29]에 존재하는 생합성 경로를 재구성하여 원하는 제품을 생산하는 미생물 세포 공장을 확보하여 목표 화합물의 대규모 생산을 달성하는 것이다.따라서 Luo Han Guo에서 M5 합성의 분자 메커니즘을 명확히 하는 것은 합성 생물학을 이용하여 세포 공장을 건설하고 체외 합성을 달성하는 데 기초를 마련할 것입니다.
2.1모그로사이드의 축적 패턴
의 축적 패턴을 이해합니다Mogroside is conducive to a better 분석의the molecular mechanism 의M5 synthesis. Research on the accumulation pattern 의Mogroside during the development 의Luohanguo has shown that the netcontent 의Mogroside is conserved, that is, the total content 의Mogroside remains unchanged throughout the growth process [42]. During the 일찍단계의fruit development, the glycosides are mainly 에서the form of Mogroside IIE, with R1 and R2 both being monosaccharide groups. This indicates that the 일찍step 에서the glycosylation of the glycosides is two primary glycosylations, after which the second glycosyl group is linked to R1 에 의해a β-1,6-glycosidic bond, resulting 에서the accumulation of mogrosideIIIX. At a later stage (77 d after flowering), a large number of tetrasaccharide products appeared, mainly sialenoside (Siamenoside), whose R1 contains a branch formed 에 의해a β-1,6-glycosidic bond and a β-1,2-glycosidic bond. 이소비of tetrasaccharide products began 77 days after flowering, and accumulation of R2 M5, which contains two sugar moieties, increased sharply during the final stage of maturation. 이ma에서component of the sweetglycoside 에서mature 과일103 d after flowering is M5. The accumulation pattern of mogrosidesuggests that the biosynthetic pathway of M5 is that mogroside first undergoes primary glycosylation at the C3 and C24 positions, and then branched glycosylation is carried out on this basis [32].
2.2 Mogroside V 생합성 경로 분석
전사체 및 대사체 분석은 식물 천연물의 생합성 경로를 해명하는데 효과적인 전략이다 [43].2016년 이스라엘 연구진 Itk에서et알다.[32]은 Luo Han Guo의 전사체 및 게놈 데이터를 기반으로 M5 생합성 경로를 완벽하게 분석하는 데 성공했다 (그림 2). M5 생합성 경로는 대략 세 단계로 나눌 수 있다:상류 전구체 합성 단계, 중류 골질 형성 단계, 하류 모핵 생산 및 변형 단계.
2.2.1전구체인 IPP와 DMAPP의 합성
테르펜 합성을 위한 상류 전구체로는 이소펜테닐피로인산염 (isopentenyl pyrophosphate, IPP)과 디메틸알릴피로인산염 (dimethylallyl pyrophosphate, DMAPP)이 있다.식물에서 IPP와 DMAPP의 생합성을 위한 두 가지 다른 경로가 있다:mevalonic 산경로 (MV한경로)와 mehyl-erythritol phosphate 경로 (MEP 경로).다양한 경로의 선택은 합성 생성물의 종류와 세포 하부 공간 위치 [45]에 따라 달라진다.MEP 경로는 plastide [46]에서 monoterpenes,diterpenes, tetraterpenes의 합성에 주로 사용되며, MV한경로는 세포질 [47]에서 sesquiterpenes, triterpenes, polyterpenes의 합성에 주로 사용된다.그러나이 둘은 완전히 독립적인 것은 아니며, 일반적인 중간 IPP는 plastid 막을 통해 서로 사용할 수 있다 [48].
M5는 세포질 내 triterpene saponin 생성물이며, 전구물질인 IPP와 DMAPP은 MV한경로를 통해 acetyl coenzyme a 로부터 생성된다.먼저 아세틸 코엔자임 A의 두 분자는 아세틸 코엔자임 A 티오에스터라제 (ATOT)와 3-하이드록시-3-메틸글루타릴 코엔자임 A synthase(HMGS) 로부터 형성되어 3-하이드록시-3-메틸글루타릴 코엔자임 A (HMG-CoA)를 형성합니다.그런 다음, 3-hydroxy-3-methylglutaryl coenzyme A reductase (HMGR)의 촉매 작용으로 3-hydroxy-3-methylglutaryl-CoA (MVA) 가 형성되며, 이는 methyl-D-erythritol-4-phosphate kinase (MK), methyl-D-erythritol-3-phosphate kinase (PMK) 및 methyl-D-erythritol-3-phosphate decarboxylase (MVD) 효소에 의해 IPP로 전환된다.IPP는 isopentenyl pyrophosphate isomerase (IPI) 효소에 의해 이중 결합 이성질체인 dimethylallyl pyrophosphate (DMAPP)로 전환된다.
2.2.2 골격의 형성 24,25-epoxygulldienol
Geranyl pyrophosphate synthase(PS)는 IPP 및 DMAPP 으로부터 Geranyl pyrophosphate (GPP)의 형성을 촉매한다.그런 다음 Farnesyl pyrophosphate synthase(FPPS)는 IPP 한 분자로부터 Farnesyl pyrophosphate (FPP)의 합성을 촉매합니다.FPP는 스쿠알렌synthase (SQS)에 의해 스쿠알렌(SQ)로 변환된다.SQS는 두 개의 FPP 분자가 응축되는 것을 먼저 촉매하여 pre-squalene diphosphate (PSPP)를 형성하고, NADPH와 Mg2+[44]가 있는 상태에서 PSPP를 SQ로 전환시키는 이중 기능성 효소이다.
오랫동안 과학자들은 squalene epoxidase(SQE) 가 SQ의 1단계 반응을 촉매하여 선형 2,3-epoxysqualene을 형성하고, 이것이 cyclase에 의해 순환되어 골격 물질인 ulipristal[49]을 형성한다고 믿었다.그러나 최근의 연구에 의하면 아글리콘의 전구체는 cucurbitadienol이 아닌 24,25-epoxylup-20(29)-en-3-ol 이며, 전구체는 2,3-epoxysqualene이 아닌 2,3;22,23-diepoxysqualene이다.SQ는 순서대로 SQE에 의해 촉매된 2,3-epoxysqualene, 2,3;22,23-dioxosqualene을 생성하며, 후자는 cucurbitadienolsynthase (CDS) [32]의 촉매 하에 24,25-epoxygulustrenol로 순환된다.
모핵인 모그로사이드의 생산 및 개조 2.2.3
쿠쿠르비탄 테트라사이클릭 트리테르페노이드 모그로사이드의 고유한 특징은 C3, C11, C24 및 C25위치에서 부위별 산소 발생으로 모핵 모그로사이드를 형성한다 [32].따라서 모핵합성의 단계를 규명하는데 있어서 가장 큰 어려점은 그것의 독특한 히드록실화, 특히 C24와 C25위치의 트랜스 히드록실화이다.Itkin 등 [32]은 epoxide hydrolase (EPH) 가 24,25-epoxylup-20(29)-en-3-one의 C24 및 C25위치의 히드록실화를 촉매하여 trans-24,25-dihydroxylup-20(29)-en-3-one을 생성하고, 이는 CYP87 계열의 일원인 CYP87D18(CYP102801)에 의해 C11위치에서 히드록실화되며,[50]cytochrome P450 효소 (CYP450) 시스템에서 lupeol을 생성한다.히드 록실 화 반응의 순서도 제안되었다:EPH 단백질은 linear 2,3;22,23-diepoxysqualene 보다는 epoxylup-20(29)-en-1-ol에 결합하는 경향이 있으므로 EPH 반응은 CDS 순환 반응을 따른다;C11에 추가적인 친수성 히드록실기는 EPH 소수성 주머니에서 도킹을 방지하므로 EPH 반응 후에 C11 히드록실화 반응이 일어난다.
M5 합성의 마지막 단계는 모 그로사이드의 C3 및 C24위치의 당화 변형입니다.C24위치에서의 당화는 기질과 글리코실 트랜스퍼라제를 도킹함으로써 C3위치에서의 당화에 대한 친화도를 증가시킨다는 것을 발견하였다.glycosylation의 순서에 따라 결정었패턴의 축적 Mogrosides:Mogroside에 의해 처음으로 C24 위치에 기본 glycosylation를 겪을 glycosyltransferaseUGT720-269-1을 생성 Mogroside Ⅰ-A1;후자는 다음에 의해 C3 위치에 glycosylated을 생성하는 UGT720-269-1 mogroside Ⅱ E;이어서 UGT94-289-3은 C3와 C24위치에서 포도당 사슬의 분지형 당화를 담당하며, 테트라당류 중간체가 합성되어 M5[32]를 형성한다.
모그로사이드 V 합성 생물학 예비 연구 3
As a natural non-sugar sweetener, the microbial 생산of the 단백질sweetener taro sweetener has a long history of research, and has been achieved in a variety of microorganisms [51-53], but the yield is low. The biosynthetic pathway of stevioside was completely elucidated in 2013 [54]. At present, the fermentation and 합성of stevioside products have been reported, mainly including rebaudioside 한, rebaudioside D and rebaudioside M [55-56], but the yield is low, because the constructed synthetic pathway is relatively long.
2016년 수 (Xu)등 (57)은 리코리스로부터 글루쿠론산 전이동효소 GuUGAT (UGT73 계열에 속함)을 보고하여 글리시리지산의 2단계 글루쿠론산 당화를 촉매하여 글리시리지산을 형성함으로써 글리시리지산 생합성의 완전한 경로를 밝혔다.이 춘 교수 's 연구단 [58]은 glycyrrhizic acid를 생산하는 조작된 세균을 기본으로 사용하고 human glycosyltransferaseUGT1A3 유전자, human UDP-glucose dehydrogenase UGDH (Hs) 유전자, Escherichiacoli 유래 UGDH (Ec) 유전자를 도입하여 glycyrrhizic acid를 생산하는 재조합 세균을 얻었다.Mogroside와 long pathway의 생합성 경로에 대한 늦은 해명으로 인해 M5의 합성생물학에 대한 연구는 제한적이다.
섀시 셀의 선택 및 최적화 3.1
섀시 셀은 천연 제품의 합성을 위한 공장입니다.성숙한 운영 체제와 유전적 안정성을 갖춘 섀시 셀의 선택은 천연 제품의 효율적인 생산을 위한 기반입니다.모델 미생물인 Escherichia coli와 Saccharomycescerevisiae는 섀시 세포로 자주 사용된다.Saccharomycescerevisiae는 M5와 같은 복잡한 천연 산물의 이형 합성 연구에 독특한 장점을 가지고 있다:내인성의 MVA 경로와 ergosterol 합성 경로는 전구물질인 IPP, DMAPP 및 2,3-epoxy-squalene을 안정적으로 제공할 수 있으며 [59-60], 완전한 막 시스템과 전환 후 변질은 cyclase 및 CYP450의 활성 발현에 도움이 된다.2,3-epoxysqualene은 식물의 트리테르페노이드 및 스테롤 골격을 합성하기 위한 일반적인 전구체이다 [61].그러나 감미료의 생합성에서 골격 합성을 위한 전구체는 2,3;22,23-diepoxysqualene이다.Saccharomycescerevisiae에서 내인성 스쿠알렌 epoxidase(ERG1)는 2,3-epoxysqualene을 2,3;22,23-bisepoxysqualene [32,62]으로 산화시킬 수 있으며, 이는 Saccharomyces cerevisiaeERG1이 SgSQE를 대체할 수 있음을 의미한다.
Saccharomyces cerevisiae 세포에 있는 2,3-epoxysqualene의 대부분은 lanosterol synthase (ERG7) [63]를 통해 ergosterol 합성 경로로 들어가 mogroside 전환으로의 대사 유동을 위해 경쟁한다.Saccharomyces cerevisiae 균주 GIL77은 [64]ERG7의 부족으로 인해 고농도의 2,3-에폭시스칼렌을 축적하며 모그로사이드 합성과 관련된 효소의 기능을 확인하기 위한 섀시 세포로 자주 사용된다.triterpene saponin 합성에 대한 생물학적 연구가 지속적으로 진행됨에 따라 Saccharomyces cerevisiae를 최적화하여 다량의 2,3-epoxysqualene을 축적하는 전략이 점차 개선되었다.주로 다음과 같다:1) MVA 경로에서 테르펜 합성과 관련된 유전자의 과발현 [65-66];2) ergosterol synthase 억제제인 R0 48-8072 또는 CRISPR/dCas9시스템을 이용하여 ERG7 [32,63]의 발현을 억제하고, ergosterol 합성분지를 하향조절한다;3) 전역 전사 인자 UPC2의 돌연변이 유전자 upc2-1을 이용하여 MVA 경로와 관련된 유전자의 전사 효율을 직간접적으로 상향조정한다 [67].
주요 효소 유전자의 클로닝 및 발현 3.2
미생물 세포에서 M5의 de 새로합성을 달성하기 위해서는 주요 효소 유전자들이 이형적으로 조합되어야 한다.따라서 효소 유전자의 클로닝은 이형어셈블리를 위한 부분을 제공할 것이며, 효소의 이형발현은 기능성 연구의 토대를 마련할 것이다.지금까지 복제되어 발현된 주요 효소는 SQE, CDS,EPH,CYP450 그리고 glycosyltransferase이다.
스쿠알렌 에폭시다제3.2.1
스쿠알렌 에폭시다제는 많은 triterpenoid synthase 계에서 보고된 스쿠알렌의 이중 에폭시화를 수행하며 [68-70], 기능적으로 발현된 식물 스쿠알렌 에폭시다제는 모노 및 디-산화 스쿠알렌을 동시에 생성 할 수 있다 [62,71].2018년, 자 오Huan et알다.[72]은 Luo Han Guo의 SQE 유전자로 주석이 붙은 두 개의 전장 조각들을 복제하였고, 둘다 524개의 아미노산을 암호화한 1,575 bp의 완전한 개방 판독 프레임을 포함하고 있으며, 각각 SgSQE1과 SgSQE2 라고 명명하였다.SgSQEs에 의해 암호화된 단백질 서열의 n-말단은 모두 transmembrane domain을 가지고 있기 때문에 원핵생물에서 발현될 때 비활성 포함체로 존재하며 효소 활성을 확인할 수 없다.단백질 기질의 분자 도킹은 SgSQEs 가 리간드 2,3-에폭시 퀄렌과 상호작용하여 수소 결합을 형성할 수 있음을 의미하며, bis-에폭시 퀄렌을 생성하는 기능을 가지고 있을 것으로 추측된다.이후 Itkin 등 [32]은 SgSQE 단백질을 모델링하여 제1에폭사이드가 있어도 제2에폭시화의 도킹을 막지 못함을 보여 SgSQE 가 이중 에폭시화 반응을 겪을 수 있음을 알 수 있었다.
쿠쿠르비타디에놀 합성효소 3.2.2
2,3-에폭시스퀄렌은 피토스테롤과 트리테르펜 [73]의 골격을 이루는 서로 다른 종류의 산화스콸렌시클로아제 (OSC)의 촉매작용하에 양성자, 순환화, 재배열 및 탈양성자에 의해 형성된다.따라서 서로 다른 종류의 OSC 끼리 경쟁을 하게 된다.OSC 계열에 속하는 CDS는 모그로사이드의 합성에서 핵심적인 cyclase이다.그것의 발현 및 활성은 mogroside의 생산량을 결정하는 2,3-epoxysqualene의 mogroside 로의 전환의 대사 흐름에 영향을 미친다.
Dai등 [74]은 Luo Han Guo의 RNA 염기서열 분석 (RNA-seq)과 디지털gene expression profiling (DGE) 분석을 통해 sgcd를 확인하였다.cDNA는 길이가 2,800 bp 이고 2,280 bp의 ORF를 포함하고 있으며, 84.4 kDa의 예측분자량을 가진 759개의 아미노산을 가진 단백질을 암호화하고 있다.이어서 2,3-epoxysqualene을 cucurbitadienol로 순환시킬 수 있는 효모 균주 GIL77을 이용하여 SgCDS의 순환능을 확인하였다.이는 Mogroside cyclizing 2,3;22,23-diepoxysqualene이 24,25-epoxy-squalene을 생성하는 생합성 경로의 SgCDS와 일치하지 않는 것으로 보인다 (그림 2) 실제로 Itkin 등 [32]은 Saccharomyces cerevisiae와 담배 Nicotiana tabacum L을 변형시켜 SgCDS를 기능적으로 분석한 결과 SgCDS는 2,3;22,23-bisepoxysqualene 뿐만 아니라 2,3-epoxysqualene을 cyclize 하여 squalene을 만들 수 있다는 것을 발견하였으나, 후자가 Mogroside의 합성에 관여하지는 않는다.이상의 연구를 통해 2,3-에폭시 퀄렌의 경우, SgCDS의 순환화가 ERG1의 에폭시화에 선행하여 SgCDS는 주로 2,3-에폭시 퀄렌의 순환화 기능을 나타내 주는 것으로 나타났다.
CYP450과 글리코실트랜스퍼라제3.2.3
CYP450은 테르펜, 플라보노이드, 알칼로이드, 리그닌 [75]과 같은 천연 산물의 산화에 핵심적인 역할을 하는 식물의 유전자 상과이다.엄격한 기질 특이성과 낮은 시퀀스 유사성을 가지고 있습니다.글리코실트랜스퍼레이스는 두 번째로 큰 식물효소계열 1UGTs의 구성원일 수 있으며, 이들은 다른 당 또는 당을 다른 수용체로 전달하며, 다른 글리코실트랜스퍼레이스를 필요로 한다 [76].따라서 특정 대사산물의 생합성을 촉매하는 CYP450과 glycosyltransferase 유전자를 효율적으로 발견하여 복제하는 것은 상대적으로 어렵다.탕등 (77)은 개화 후 50~70 d 이후 빠르게 축적되는 M5와 결합하여 RNA-seq와 DGE의 혼합 응용을 바탕으로 7개의 CYP450s와 5개의 udpg를 M5의 합성을 담당하는 후보 유전자로 확인하고 screening 하였다.이 방법은 비모델 식물에서 새로운 2차 대사산물의 생합성을 담당하는 후보 유전자를 식별하는 효과적인 방법을 만들었다.
장등 [50]은 Luo Han Guo에서 다기능성 cytochrome P450 효소 (CYP87D18)와 glycosyltransferase (UGT74AC1)를 확인하였다.In vitro 효소 활성 검사 결과 CYP87D18은 furostanol의 C11위치의 산화를 촉매하여 11-oxofurostanol과 11-hydroxyfurostanol을 형성하는 역할을 하는 것으로 나타났다;UGT74AC1은 구체적으로 로가니놀의 C3위치로 포도당을 이동시켜 로가닌 IE를 형성할 수 있다.거의 동시에 Itkin 등 [32]은 모모디카그로베노리에서 191개의 CYPs와 131개의 UGTs를 확인하였고, 개발 과실에서 발현되는 40개의 CYPs와 100개의 UGTs를 사전 검사하였다.기능성 검증은 효모와 대장균에서 각각 수행하였다.그 결과, CYP87D18 (CYP102801)은 트랜스-24,25-디 히드 록시 cholest-4-en-3-one의 C11위치의 히드 록시 화를 촉매하여 로스 몰산을 생성하고;UGT74-345-2, UGT75-281-2, UGT720-269-1 및 UGT720-269-4는 C3위치에서 1차 당화를 담당하며, UGT720-269-1은 C24위치에서 1차 당화를 담당하는 유일한 효소이기도하다.UGT720-269-1, UGT94-289-1, UGT94-289-2 및 UGT94-289-3은 C3 및 C24포도당 사슬의 분지된 당화를 담당한다.
쿠쿠르비타디에놀의 생합성 3.3
이소연 등 [78]은 실험실에서 얻은 트리테르페노이드 화합물을 이용하여 효모 차체균주인 WD-2091에서 클로닝 된 SgCDS를 이형적으로 발현하여 발효시켰으며 (FPS,SQS,SQE 및 MVA 경로는 과발현 및 조절), 클로닝 된 SgCDS는 이형적으로 발현되어 발효되었으며 쿠쿠르비타디에놀의 수율은 27.44 mg/L 이었다.CDS 유전자는 고복사의 플라스미드 pRS425에서 저복사의 플라스미드 pRS313으로 더욱 이동하여 CDS 유전자의 발현을 조절하였으며, 313-SL-CB Saccharomyces cerevisiae 세포공장을 얻었으며, 쿠커비타디에놀의 생산이 202.07% 증가하였다.고밀도 발효 수율은 1,724.10mg/L에 달하였으며, 이는 현재 쿠쿠르비타디에놀의 미생물 합성 중 가장 높은 수율이다.이번 연구로 쿠커비트형 테트라사이clic 트리테르페노이드 생산을 위한 효율적인 세포 공장을 만들 수 있는 토대가 마련됐다.
M5를 위한 미생물 세포 공장의 건설은 원래의 생합성 경로를 이전하거나 전체 대사 경로를 재공학 및 건설하는 것을 포함할 수 있다.쿠쿠르비타디에놀이 로가닌의 합성을 위한 골격이 아니라는 것이 입증되었지만, 쿠쿠르비타디에놀을 고농도로 생산하는 공학된 세균 313-SL-CB는 차대세포로 사용될 수 있다.oxidase 유전자를 재결합하여 쿠쿠르비타디에놀을 24,25-epoxycucurbitadienol로 전환한 후 EPH,CYP450 및 글리코실트랜스페라제에 의해 촉매되어 M5를 생성할 수 있다 (그림 3).
논의 및 전망 4
피플 &의 개선으로#39;의 건강에 대한 인식, 소비자 '음식에 대한 추구는 더 이상 그들의 미뢰를 만족시키는 데 국한되지 않고, 건강과 기능성에도 점점 더 관심을 기울이게 되었고, 이로 인해 무설탕 천연 감미료 [30]에 대한 수요가"폭발적인"증가하게 되었다.특히 월드 & 중 하나인 M5#39;의 가장 강한 천연 감미료, public&를 만날 뿐만 아니라#39;s demand as a natural non-sugar sweetener, but also serves as a sucrose substitute 을diabetics and obese people due to its medicinal properties [79]. The demand 을M5 is gradually increasing worldwide [80], and plant extraction methods can no longer meetmarketdemand. 합성 생물학has unique advantages in the 효율적인and sustainable extraction of natural plant products, and has been applied to the 합성of various natural products [81-83]. Therefore, the large-scale production of M5 using synthetic biology is an inevitable trend. At present, the biosynthetic pathway of M5 has been completely elucidated, and the key 효소have been cloned and functionally verified, but research on microbial production is still lacking.
합성생물학의 원리를 바탕으로 M5세포 공장 건설을 위한 두 가지 전략을 제안합니다:먼저, 위에서 언급한 바와 같이 (그림 3), 가장 편리한 방법인 높은 생산량의 쿠쿠르비타디에 놀 생산 공학적 박테리아 313-SL-CB를 기반으로 M5로의 형질전환이 가능합니다;둘째,2,3;22,23-dioxo-squalene을 M5로 전환하는데 관여하는 5개의 효소 유전자를 효모세포에 재결합하여 de novo 합성을 할 수 있다 (도 2).이 두 가지 전략을 이용하여 M5 활성 분자의 미생물 생산을 실현하는 데에는 아직 많은 어려움이 있는데, 첫째, 첫 번째 전략에서 스쿠알렌이 24,25-epoxysqualene으로 산화하는 촉매작용을 하는 효소가 발견되지 않았고, 두 번째 전략인 yeast's 내인성 ERG1, SgCDS에 충분한 2,3;22,23-bisepoxysqualene을 제공할 수 없다.둘째, M5 생합성 경로에는 많은 효소와 중간체가 관여하고, 대사과정이 복잡하며, 하나의 미생물 세포에 통합된 외인성 유전자의 효율적이고 조직적인 발현이 어려우며, 또한 숙주에 더 큰 대사압력을 유발한다.마지막으로 SgCDS, UGT720-269-1 및 UGT94-289-3은 모두 다양한 기질에 작용하여 서로 다른 생성물을 형성할 수 있는 비특이적 효소이며, 차체세포에서 촉매작용의 순서와 방향은 제어하기 어렵다.
문제점을 해결하기 위해, 우리는 다음과 같은 전략을 제안한다:에폭시 화 반응을 효율적으로 촉매하는 lupeol 및 SQEs 로부터 24,25-epoxylupeol의 생산을 촉매하는 산화효소를 식별하고 걸러낸다;더 정확하게 2,3-에폭시 스쿠알렌의 하류 경로를 조절하고 2,3-에폭시 스쿠알렌은 더 mogroside의 합성쪽으로 향합니다.최근 모듈식 공동 재배 공학은 세포 스트레스를 줄이고 목표 산물의 생산을 증가시키기 위한 새로운 전략이 되었다 [84-85].따라서, M5의 생합성 경로는 서로 다른 모듈로 합리적으로 분할될 수 있으며, 각 모듈은 특정 균주로 통합될 수 있다.모집된 균주를 한 공간에 집적시킨 후, 모집된 균주를 공동 배양하여 M5의 de novo 합성을 달성할 수 있다.구조 생물학은 효소 단백질의 구조를 분석하고 특정한 촉매 메커니즘을 이해하는 데 사용되며, 파르네실 전달 효소와 글리코실 전달 효소의 기질 특이성은 적절한 효소 변형을 통해 향상된다.주요 화합물 실시간 모니터링 및 대사 동적조절 기술을 개발하여 효소의 지시성 촉매화를 달성한다.합성생물학과 대사공학의 발달로 M5의 저비용 대규모 생산이 반드시 실현될 것이다.
참조:
[1] 수에즈 운하 J, Korem T, Zeevi D, et 알다. 인공 감미료 유도 glucose 편협 함 에 의해 변경 직감 microbiota다. 자연, 2014년, 514 (7521):181-186.
[2] Kokotou MG, Asimakopoulos AG, Thomaidis NS다.인공 sweeteners as 신흥 오염물질 환경에서: 분석 방법론 그리고 환경적인 영향이다.항문방법, 2012, 4(10):3057-3070.
[3] 굽타 P, 굽타 N, Pawar AP, et 알다. 역할 설탕 (sugar)과 sugar 대용 품 in dental 충치: a 검토.ISRN Dent, 2013, 2013:519421.
[4] Bray GA, 팝 킨 BM이다. 식이 sugar and 몸무게:비만의 만연 속에서 우리는 위기에 이르렀는가 and 당뇨?: 건강 be 빌어먹을! 붓 설탕 위에.당뇨관리, 2014년,37(4):950-956.
[5] 양QH,장ZF,Gregg EW,외.설탕 섭취와 심혈관 질환 사망률 증가 어른들은다. 매복 인턴 병원, 2014년, 174 (4):516-524.
[6] Ś wiader K,Wegner K,Piotrowska 한,etal.a 로서의 식물 source of natural hid 감미료: 검토 한다.JAppl Bot 음식Qual, 2019, 92:160-171.
[7] Kroger M, 마이스터 K, 카 바 R. 저칼로리 감미료와 다른 설탕 대체물:에 대한 검토 safety 문제이다. Compr Rev 음식 Sci 음식 Saf, 2006, 5(2):35-47.
[8] 진 ML, Muguruma M, 삼는 M, et 알다. Thirteen-week 반복 복용 량 독성 of Siraitiagrosvenori 추출 in Wistar 하노버 쥐 (개최 한)이다.음식화학Toxicol, 2007, 45(7):1231-1237.
[9]. Kinghorn 광고, Kaneda N, 백 니, et 알. Noncariogenic 강렬한 자연 감미료.Med ResRev, 1998, 18(5):347-360.
[10] Adeogun 오, Adekunle 한, Ashafa A. 화학 구성, 치사 율 and 항진 균 성 활동 of the 추출 of 잎 of Thaumatococcus danielliiagainst 음식에서 균 류다. Beni-Suef 대학 J Basic Appl Sci, 2016년,5(4):356-368.
[11] Goyal SK, 삼 셔, Goyal 였다. Stevia (Stevia rebaudiana) 한 bio-sweetener: a 검토. 정수 J Food SciNutr, 2010년,61(1):1-10.
[12] 싱 민주당, 쿠 마리 M, 프라 카 쉬 HG, et 알 케 and pharmacological 중요성 스테비아의:칼로리가 없는 천연 감미료.Sugar Tech, 2019, 21(2):227-234.
[13] Jin JS), 이제현 (리JH.Siraitia grosvenorii, luo han kuo의 Phytochemical and pharmacological aspects Siraitia의grosvenorii, luo han kuo.Orient Pharm Exp Med, 2012, 12(4):233-239.
[14] 장 XB, 노래 YF, 딩 YP 가, et 알다. 효과 mogrosides의 on high-fat-diet-induced 비만 그리고 쥐의 비알코올성 지방간 질환.분자, 2018, 23(8):1894.
[15] 미즈타니 K,쿠라모토 T,타무라 Y 등.단맛 glycyrrhetic 산의 3-O-β-D-monoglucuronide 및 관련 glycosides다.Biosci Biotechnol Biochem, 1994, 58(3):554-555.
[16] Isbrucker RA, 우엉 GA다. 위험 and 안전성 평가 on the consumption of 감초 루트 (Glycyrrhiza sp.), 그 추출물 및 분말을 식품성분으로서 약리학 및 독성학에 중점을 두고 있다 of glycyrrhizin다. Regul Toxicol Pharmacol, 2006, 46(3):167-192.
[17] 두 보이스 GE, 프라 카 쉬 I.Non-caloric 감미료, 단맛 , 아무런 and sweetener 제다.Annu RevFood SciTechnol, 2012, 3:353-380.
[18]. 윌리엄 슨 EM,류 XM,이조 AA. 신흥 한방 뉴트럴 코스메틱의 사용현황, 약리학 및 임상적용 동향.Br JPharmacol, 2020년,177(6):1227-1240.
[19] 마 츠 모토 K, Kasai R, 맡는다 K, et 알다. 가 벼 운 cucurbitane-glycosides 에서 과일 of Siraitia grosvenori (Cucurbitaceae)이다.Chem Pharm Bull, 1990, 38(7):2030-2032.
[20] 류 T, 왕 XH, 리 C, et 알다. 연구 on Momordica grosvenori 사의 saponin V의 항tussive, 거담제 및 항경련 효과.Chin Pharm J,2007, 42(20):1534-1536, 1590.
[21] 류 C, Dai LH, Dou DQ, et 알다. A natural 음식 감미료 with anti-pancreatic cancer 속성이다.Oncogenesis, 2016, 5(4):e217.
[22] Takasaki M, Konoshima T, 무라타 Y, et 알다. Anticarcinogenic 활동 of natural 감미료, 모모르디카 그로베노리의 쿠쿠르비탄 글리코사이드.암렛, 2003, 198(1):37-42.
[23] 첸 WJ, 왕 J, Qi XY, et 알다. The 항 산화 활동 자연의 감미료, mogrosides, 과일 로부터 of Siraitia grosvenori다. 정수 J Food Sci Nutr, 2007, 58(7):548-556.
[24] 저 우Y,Zheng Y,Ebersole J외.Luo Han Kuo (Siraitia grosvenori Swingle) 과실 추출물의 mogroside V와 과실 추출물의 인슐린 분비 자극 효과.Acta Pharm Sin, 2009, 44(11):1252-1257.
[25] Tu DQ, 엄마 XJ, 자 오 H, et 알다. 복제 and Siraitia grosvenorii의 SgCYP450-4의 발현.Acta Pharm Sin B, 2016, 6(6):614-622.
[26] Makapugay HC,Nanayakkara NPD, Soejarto DD, 외. 고성능 액체 LoHan Kuo 과일에 대한 주요 달콤한 원리의 크로마토그래피 분석.JAgric Food 화학,1985, 33(3):348-350.
[27] 라오 시니어, Ravishankar GA다. 식물 셀 문화:화학 공장 of 보조 있습니다.Biotechnol Adv, 2002, 20(2):101-153.
[28] Dudareva N, DellaPenna D. 식물 대사 공학: 미래 전망 and 과제 가 있습니다. 큐어오핀바이오테크놀, 2013, 24(2):226-228.
[29]. Smanski MJ, Zhou H, Claesen J, et 알다. Synthetic biology to 액세스 and 확장 자연의 화학 다양성 입니다.냇Rev 마이크로바이올, 2016, 14(3):135-149.
[30] 필립 RN, 드 Mey M, 앤더슨 J, et 천연 제로 칼로리 감미료의 바이오 테크놀로지 생산 al. Curr Opin Biotechnol, 2014년, 26:155-161.
[31] 카메론 드, 바쇼어 CJ, 콜린스 JJ.…의 간략한 역사 synthetic 생물학. 냇 Rev Microbiol, 2014, 12(5):381-390.
[32] Itkin M, Davidovich-Rikanati R,Cohen S, 외.nonsugar, 고강도 감미료의 생합성 경로 mogroside V 에서 Siraitia grosvenorii다.Proc Natl Acad Sci 미국, 2016, 113 (47):E7619-E7628.
[33] 리 민주당, 장 HR. 연구 and 사용 of 중국medicine Luohanguo-a 특별 한 로컬 product 광 시성의다. Guihaia, 2000년, 20 (3): 270-276다.
[34] 리 발이다. 강렬 한 sweetener 에서 Lo Han 쿠오 (모모디 카그로베노리). Experientia, 1975년, 31일 (5):533-534다.
[35] Kasai R,Nie RL,Nashi K, 외.달콤한 쿠쿠르비탄 글리코사이드 에서 fruits 시라이티아 시아멘시스의 (chi-zi luo-han-guo), a Chinese 민속 약이다.Agric Biol화학,1989, 53(12):3347-3349.
[36] Ukiya M, Akihisa T, Tokuda H, et 알다. Momordica grosvenori의 열매로부터 Epstein-Barr에 대한 cucurbitane glycosides 및 기타 triterpenoids의 억제 효과 (Inhibitory effects of cucurbitane glycosides 그리고 다른triterpenoids 에서fruit of Momordica grosvenori on Epstein-Barr 바이러스 early 에 의해 유도된 항원 종양 12-O-tetradecanoylphorbol-13-acetate 입안자이 십니다.JAgric Food Chem, 2002, 50(23):6710-6715.
[37] 왕L,리LC, Fu YX 외.일련의 mogrol 유도체의 분리, 합성 및 세포 독성.J Asian Nat Prod Res, 2019:1-15.
[38] 무라타 Y, 요시카와 S, 스즈키야 외.단맛 특성 of the triterpene glycosides in Siraitia grosvenori다. J Jpn Soc Food Sci Technol, 2006, 53(10):527-533.
[39] 타케모토 T,아리하라 S, 나카지마 T 등.에 관한 연구 Studies on the 유권자들 fructus의 momordicae다. 나는다. 에 달콤한 원칙이다. Yakugaku Zasshi, 1983년, 103 (11):1151-1154.
[40] 타케모토 T, 아리하라 S, 나카지마 T 등.부제:Studies on the 유권자들of fructusmomordicae.II.구조의 sapogenin다. Yakugaku Zasshi, 1983년, 103 (11):1155-1166.
[41] 타케모토 T, 아리하라 S, 나카지마 T 등.에 관한 연구 Studies on the constituents of fructus momordicae다. 3세다.구조 of mogrosides다. Yakugaku Zasshi, 『 한국행정학보 』 1983, 103(11):1167-1173.
[42] 리DP, Ikeda T, Huang YL,외.Lo Han Kuo (Siraitia grosvenori) 과실의 계절적 변동 (Seasonal variation of mogrosidesin Lo Han Kuo (Siraitia grosvenori) fruits)J Nat Med, 2007, 61(3):307-312.
[43] 잇킨 M, 하이니그 U, 츠파디아 오,외.antinutritional의 생합성 알 칼 로이드 in solanaceous 농작물 이 중재 에 의해 클러스터 된 유전자이다. 과학, 2013, 341(6142):175-179.
[44] 해리슨 DM다. The biosynthesis of 트리테르페노이드, 스테로이드, 카로티노이드 등이 있다.Nat Prod Rep, 1990, 7(6):459-484.
[45] 랭 BM, Ahkami A. 대사 공학 의 식물 monoterpenes, sesquiterpenes 그리고 diterpenes-current 상태 and 미래 기회다.식물Biotechnol J, 2013, 11(2):169-196.
[46] 부비 F, Rahier 한, 카마라 B. Biogenesis, 분자 규정 and 함수 of 식물 isoprenoids다.Prog Lipid Res, 2005, 44(6):357-429.
[47] Liao P, Hemmerlin A, Bach TJ 외.향상된 아이소프레노이드 생산을 위한 메발로네이트 경로의 가능성.Biotechnol Adv, 2016, 34(5):697-713.
[48] Laule 오, Furholz A, 장 씨는 HS, et 알다. 잡음 사이 streptozotocin 유도 and plastidial 경로 isoprenoid의 biosynthesis in Arabidopsis thaliana다.Proc Natl Acad Sci USA, 2003, 100(11):6866-6871.
[49] 시부야 M, Adachi S, Ebizuka Y. Cucurbitadienol synthase, 쿠쿠르비타신 생합성을 위한 첫 번째 효소는 사이클로아르테놀과는 다른 효소이다 synthase 을 phytosterol biosynthesis다.사면체, 2004, 60(33):6995-7003.
[50] 장 JS, Dai LH, 양 JG, et 알다. 산화 cucurbitadienol의 촉발시 에 의해 CYP87D18 in Siraitia grosvenorii 로부터 mogrosides의 생합성.식물세포생리학, 2016, 57(5):1000-1007.
[51] Lee 문제이, Weickmann JL,, Koduri 였, et 표현 알다. of synthetic thaumatin 유전자 in 이스트.생화학, 1988, 27(14):5101-5107.
[52] Daniell S, Mellits KH,Faus I, 외.단 맛을 다시 접는 것 protein thaumatin II 에서 불용 성 포함 몸 synthesised in Escherichia 콜리다.Food Chem, 2000, 71(1):105-110.
[53] Masuda T, Kitabatake N. 발전 biotechnological에서 production of 달콤한 단백질이다. J Biosci Bioeng, 2006, 102(5):375-389.
[54] (영어) Ceunen S, Geuns JMC.스테비올 글리코사이드:화학적 다양성, 신진대사, and 기능이 있다. J Nat Prod, 2013, 76(6):1201-1228.
[55]. 왕 JF, 리 SY, 웅 정필 ZQ, et 알다. Pathway mining-based integration of critical enzyme parts for de novo biosynthesisof steviolglycosides sweetener in Escherichia coli (대장균).셀레스, 2016, 26(2):258-261.
[56] 올슨 K, 칼슨은 S, Semmler 한, et 알다. 미생 물의 생산 of 차세대 stevia 감미료다.Microb 셀Fact, 2016, 15:207.
[57] 수 (Xu) 공전주기는, 채 W, 가 오 W, et 알다. A 소설 glucuronosyltransferase has an 전례 없는 능력 to 촉진시 지속적인 두 단계로 glucuronosylation of glycyrrhetinic 산 to glycyrrhizin 양보 했다.신피톨, 2016, 212(1):123-135.
[58]. 리 C, 자 오 YJ, 펭 XD, et 알다. 응용 프로그램 glycosyl의 transferase in glycyrrhizic acid 합성:CN, 110106222.2019-08-09다.
[59] 류 JD, 장 WP, 두 GC 등.제라니올의 과잉 생산 by 향상 된 전조 공급 Saccharomyces에서 cerevisiae다. J Biotechnol, 2013, 168(4):446-451.
[60] 어거스틴 JM, Kuzina V, 앤더슨 누군가 가, et 알다. 분자 활동, biosynthesis and 진화 triterpenoid의 saponins다.Phytochemistry, 2011, 72(6):435-457.
[61] Guo HH, Li RF, 류 누군가 가, et 알다. 분자 성격묘사, 표현, and 규정 Gynostemma pentaphyllum squalene epoxidase유전자의
1. 식물생리학 Biochem, 2016, 109:230-239.
[62] Rasbery JM, Shan H,LeClair RJ 외.Arabidopsis thaliana squalene epoxidase 1 is 필수적인 뿌리와 씨앗 개발을 위해.J BiolChem, 2007, 282(23):17002-17013.
[63] 유 Y, 장 씨는 PC, 유 H, et 알다. 생산적인 amyrin synthases for efficient α-amyrin 합성 조작에 Saccharomyces cerevisiae다. ACS 신스비올, 2018, 7(10):2391-2402.
[64] 왕 ZH, 예 이츠 T, Han H, et 알다. 복제 그리고 성격 묘사 of oxidosqualene cyclases 칼랑코에 다이그레몬티아나로부터: enzymes 촉매 up to 10 기류 단계 양보 friedelin and other triterpenoids다. J Biol Chem, 2010, 285 (39):29703-29712.
[65] 야 오 밍 Z, 조우 PP, Su BM, 외.아이소프렌 생산 강화 by 재건 대사 사이의 균형을 강화 전조 공급 와 개선 된 isoprene synthase in 미세 한다.ACS Synth Biol,2018, 7(9):2308-2316.
[66] Paramasivan K, Mutturi S. HMG-CoA reductase 활성과 결합한 NADPH의 재생은 squalene을 증가시킨다 synthesis in Saccharomyces cerevisiae다. J Agric Food Chem, 2017, 65(37):8162-8170.
[67] Ro DK, 파라다이스엠, Ouellet M 등이 참여했다.antimalarial drug precursor artemisinic acid in engineered yeast의 생산.자연, 2006, 440(7086):940-943.
[68] 넬슨 JA, 스텍벡 SR, 스펜서 TA.Biosynthesis의 24, 25-epoxycholesterol 에서 스쿠알렌 2, 3; 22일, 23-dioxide다. J Biol Chem, 1981년, 256 (3):1067-1068다.
[69] Boutaud O, Dolis DH, Schuber F. 우선 cyclization of 2, 3, (S):22일 (S), 23-dioxidosqualene 포유류에 의해 2, 3-oxidosqualene-lanosterol cyclase다.생화학 Biophys Res Commun, 1992년, 188 (2):898-904다.
[70] Godio RP, Fouces R, 마틴 JF다. A squalene epoxidase is 관련 된 in biosynthesis 모두의 항암 화합물인 clavaric acid와 sterols는 basidiomycete H. sublateritium다. Chem Biol, 2007, 14(12):1334-1346.
[71] 스즈키 H, Achnine L, Xu R, et 알다. A 유전 체 학 접근 to the early stages triterpene의 Medicago truncatula의 saponin 생합성.플랜트 J, 2002, 32(6):1033-1048.
[72] Zhao H, Guo J, Tang Q, et 알다. 복제 과 표현 analysis of squalene epoxidase Siraitia grosvenorii의 유전자.중국 J 친 마터메드, 2018, 43(16):3255-3262
[73] 우 TK, 장 씨는 CH, 류윗 (류YT), et 알.saccharomyces cerevisiae oxidosqualene-lanosterol cyclase: 한 chemistry-biology 학문분야 연구 of 단백질의 structure-function-reaction 메커니즘 관계.한국화학연구원, 2008, 8(5):302-325.
[74] Dai LH, 류 C, 주 YM, et 알다. 기능적 특성 of cucurbitadienol synthase 그리고 triterpene glycosyltransferase involved biosynthesis에서 of mogrosides 에서 Siraitia grosvenorii다. Plant Cell Physiol, 2015년, 56 (6):1172-1182.
[75] Han JY, 김 HJ, 권 씨는 YS, et 알다. The Cyt P450 효소 CYP716A47 catalyzes the 형성 ginsenoside 중 dammarenediol-II 로부터 protopanaxadiol의 biosynthesis in 파낙 스 인삼이다. 식물세포생리학, 2011, 52(12):2062-2073.
[76] Caputi L, Malnoy M, Goremykin V, et 알다. A genome-wide phylogenetic reconstruction of family의 약자이다
1 UDP-glycosyltransferases는 식물이 육지에서의 생활에 적응하는 과정에서 과가 확장됨을 밝혔다.플랜트 J, 2012, 69(6):1030-1042.
[77] 탱 Q, 마 XJ, 모 CM 등.…에 대한 효율적인 접근 찾는 Siraitia grosvenorii triterpene 생합성 유전자 by RNA-seq and digital 유전자 발현 분석.BMC Genomics, 2011, 12:343.
[78] Li SL, 왕D, 류Y 등.쿠쿠르비타디에놀의 이형질 효율적 합성 연구.중국 J 친마터메드, 2017, 42(17):3326-3331.
[79] 시아 Y, Rivero-Huguet 나, 휴즈 BH, et 알다. 격리 of the 달콤한 구성 요소 from Siraitia grosvenorii다.푸드켐, 2008, 107(3):1022-1028.
[80] Wang L, Yang ZM, 루 플로리다, et al. Cucurbitane glycosides 파생 된 from mogroside 급급:structure-taste 관계, 항 산화 활동, 그리고 급성 독성이다. 분자, 2014, 19일 (8):12676-12689다.
[81] Liu LQ, Liu H, Zhang W, et al. 공학 그 biosynthesis of caffeic acid in heterologous enzyme 조합의 Saccharomyces cerevisiae.공학, 2019, 5(2):287-295.
[82] Srinivasan P, Smolke CD. 공학 미생물의 생합성 플랫폼 for de novo production 트로페인 알칼로이드의.Nat Commun, 2019, 10:3634.
[83] 첸 HF, Zhu CY, Zhu MZ 외.valencene의 생산량이 많다 in Saccharomyces cerevisiae 대사공학을 통해서요.Microb Cell Fact, 2019, 18:195.
[84] Wang RF, Zhao SJ, Wang ZT, 외.…의 최근 발전 모 듈 코 컬 공학 for synthesis 자연의 제품이다. Curr Opin Biotechnol, 2020, 62:65-71.
[85] Li ZH, Wang XN, Zhang HR. 밸 런 싱 비선형 rosmarinic acid biosynthetic pathway by modular 코 컬 공학 입니다. Metab 엥, 2019, 54:1-11.


 영어
영어 프랑스
프랑스 스페인
스페인 러시아
러시아 한국
한국 일본
일본




