Superfood Spirulina: Things You Never Knew
1 Introduction: 이Ancient 그리고Miraculous Superfood—Spirulina
Did you know? There exists an ancient superfood 에Earth that has quietly accompanied our planetfor 3다.5 billion years—it's spirulina!
This tiny blue-green algae, viewed under a microscope, displays an elegant spiral shape. Though small in size, it packs astonishing nutritional power. Not only is it one 의Earth's oldest life forms, but it also stands as nature's gift—a natural treasure trove 의nutrients for humanity.
✨ Why is it called a “Superfood”?
Spirulina's excellence lies in its exceptional nutritional value:
· Protein content as high as 60%-70%, surpassing most animal 그리고plant sources
· Contains all 8 essential amino acids required by the human body, making it a “complete protein”
· Rich in B vitamins, beta-carotene, iron, calcium, and other micronutrients
· Its unique phycocyanin possesses potent antioxidant and anti-inflammatory properties
Due to these extraordinary qualities, UNESCO has hailed spirulina as “the most ideal future food for humanity,” and NASA has recommended it as space food for astronauts.
Wide-Ranging Applications and Health Benefits
Today, spirulina has become a star ingredient in the health industry:
· As a dietary supplement, it helps boost immunity and improve gut health
· As a new plant-based protein source, it offers a premium nutritional choice for vegetarians
· Incorporated into functional foods, skincare products, and even animal feed
· Research indicates potential in alleviating allergies and regulating blood sugar
MarketDemand and Cultivation Challenges
With rising global health awareness, the spirulina marketcontinues to expand, 와annual consumption reaching thousands of tons. However, achieving widespread adoption faces significant hurdles:
· Traditional cultivation methods are costly and yield low output
· Susceptible to microbial contamination and rotifer infestations
· Cultivation conditions directly impact nutrient content

Scientific Cultivation is Key
Though spirulina grows rapidly and adapts well to diverse environments, its quality is meticulously influenced by multiple factors: 에서nitrogen source selection and light regulation to temperature management and contamination control—each step determines the final product's quality and yield.
This article delves into the science of spirulina cultivation, revealing how optimizing conditions achieves the perfect balance of high yield and superior quality—empowering this ancient superfood to better serve human health.
2 Key Factors Influencing 스 피 루 리나Growth
2.1 Nitrogen Sources: The “Protein Factory” 스 피 루 리나의Growth
One of spirulina's most remarkable features is its exceptionally high protein content, reaching 50%–70%, making it a natural protein treasure trove. Nitrogen is an indispensable raw material for protein synthesis. Therefore, the type and quantity of nitrogen sources directly determine spirulina's growth vigor and protein concentration.
Commonly used nitrogen sources include sodium nitrate (NaNO₃), urea, ammonium chloride (NH₄Cl), and sodium glutamate. Each exerts distinct effects on spirulina growth.
For instance, studies reveal that under identical cultivation conditions, urea yields nearly equivalent spirulina production despite being only half the concentration of sodium nitrate. This indicates that spirulina “prefers” urea, growing faster and more abundantly when it is used as the nitrogen source.
Why does this phenomenon occur? There are primarily four reasons:
· “More Nutrient-Rich”: A single urea molecule provides two nitrogen atoms, whereas a sodium nitrate molecule provides only one.
· “Easier Absorption”: In alkaline culture environments, urea spontaneously converts into ammonia, which spirulina can readily absorb directly.
· “Time and Energy Savings”: Spirulina's uptake of nitrate is an “energy-intensive” process, requiring reduction to nitrite followed by conversion to ammonia—a step that consumes additional energy.
· “Too much of a good thing”: Not all nitrogen sources are beneficial in excessive amounts. Concentrations that are too high (e.g., urea exceeding 200 mg/L) can actually inhibit growth because excess nitrogen converts into toxic ammonium ions.
Additionally, familiar substances like monosodium glutamate (MSG) can serve as nitrogen sources. At low concentrations (below 1 g/L), it promotes spirulina growth and increases protein and β-carotene content; however, excessively high concentrations overwhelm spirulina's “digestion” capacity, leading to a significant decline in growth rate.
2.2 Carbon Sources: Spirulina's “Energy Package”
Just as plants absorb carbon dioxide through photosynthesis to grow, spirulina is a photosynthetic microorganism capable of utilizing CO₂ as a carbon source to synthesize energy and essential substances under light. Interestingly, in the absence of light, it can “switch modes,” utilizing organic compounds like glucose or ethanol as carbon sources to synthesize nutrients such as linolenic acid and polysaccharides.
In practical cultivation, simple organic compounds like glucose, lactose, or ethanol are commonly used as carbon sources. Their ease of control enables rapid spirulina growth within shorter timeframes. For instance, experiments show that after 14 days of cultivation using ethanol, glucose, or acetic acid as carbon sources, spirulina density increases by 20%–40% compared to CO₂ alone. Moreover, when ethanol or acetic acid is used, the proportion of beneficial fatty acids (such as GLA and alpha-linolenic acid) in the spirulina is also higher.

The judicious combination of CO₂ and organic carbon sources not only increases spirulina yield but also contributes to mitigating climate change, representing a direction for achieving green production.
2.3 pHand Temperature: Spirulina's “Comfort Zone”
Just as humans feel uncomfortable in environments that are too cold or too hot, spirulina's growth thrives within its own preferred “comfort zone”—optimal pH levels and temperatures.
Research indicates spirulina grows fastest and achieves highest protein content in slightly alkaline conditions (pH 9–10) with temperatures maintained around 30°C. This represents its “golden growth conditions.”
Not only does growth rate depend on these conditions, but spirulina's “nutritional value” is also closely tied to them. For example:
· At pH 8.5, the levels of valuable components like phycocyanin, chlorophyll, and carotenoids in spirulina peak.
· At pH 9.0, its antioxidant activity becomes most potent, with free radical scavenging capabilities exceeding the control group by over fivefold—earning it the title of “antioxidant powerhouse.”
2.4 Light: Spirulina's “Sunlight Diet”
As a photosynthetic microorganism, light serves as Spirulina's most vital “energy source” for growth. The color of light, daily exposure duration, and intensity directly influence spirulina's growth rate and nutritional composition.
Generally, stronger light yields higher spirulina production. For instance, experiments show that under identical conditions, increasing light intensity 에서2.0 klx to 5.0 klx nearly doubles spirulina yield after 14 days of cultivation.
So, what “flavor” of light does spirulina prefer?
Research reveals:
· It favors “red light”: Optimal growth occurs under red light (wavelength 620-630 nm), yielding over 56% higher production than complete darkness.
· Blue and green light are also acceptable, though less effective.
· Longer exposure isn't always better: Peak production is reached with about 8 hours of daily light; exceeding 12 hours offers no additional growth and may waste energy.
Interestingly, optimal lighting can even enhance spirulina's nutritional value:
· Moderate UV exposure increases its fat content by nearly 30%.
However, excessive “sunlight feasts” can backfire—overly intense light triggers “light inhibition,” much like how overexposure to sun makes us uncomfortable, causing spirulina's growth to slow. Fortunately, research shows that increasing CO₂ concentration helps spirulina better tolerate intense light, mitigating this inhibition.
Therefore, in practical cultivation—whether in indoor tanks or outdoor ponds—light conditions require careful regulation: through timely harvesting, adjusting CO₂ levels, and controlling algae density, each spirulina plant can enjoy just the right amount of “sunlight bath.” Only then can we harvest this miraculous algae, both healthy and high-yielding.
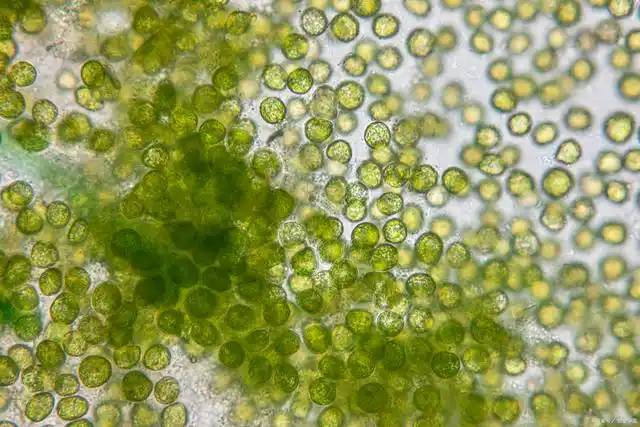
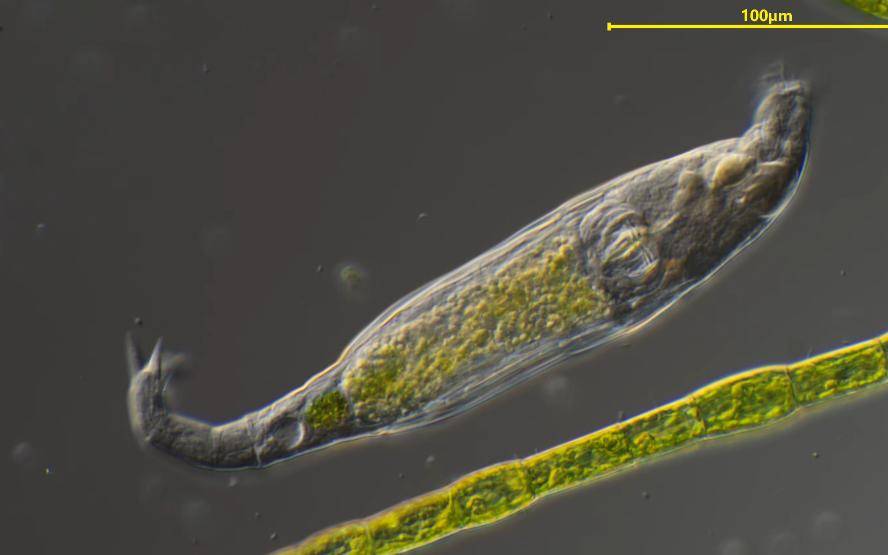
2.5 Rotifer Infestation: Spirulina's “Miniature Predator”
During spirulina cultivation, an invisible microorganism—the rotifer—emerges as its greatest adversary. These tiny, algae-feeding animals reproduce rapidly and possess strong adaptability. When proliferating massively, they can drastically reduce spirulina yields within a single day, potentially causing complete cultivation failure.
To combat rotifers, two primary methods are currently employed:
· Physical Methods: These include disinfecting cultivation equipment and water sources, or using microfiltration systems to remove rotifers. While relatively safe, these methods sometimes yield suboptimal results.
· Chemical Methods: Chemical substances like toluene or urea can effectively inhibit or kill rotifers. However, due to potential safety and residue concerns, they are unsuitable for large-scale commercial cultivation.
Consequently, scientists are actively seeking natural, safe suppression methods. Several plant-derived substances show great potential:
· Plant-based compounds like matrine, matrine-1, and azadirachtin exhibit strong toxicity toward rotifers, effectively inhibiting their reproduction and even causing mortality.
· Particularly noteworthy is azadirachtin (a botanical insecticide), which significantly reduces rotifer populations at extremely low concentrations (approximately 2 μg/L) without adversely affecting spirulina growth or photosynthesis—effectively achieving “insecticide without harm to algae.”
· Research indicates that a proportional mixture of quercetin and azadirachtin can markedly suppress rotifers within 3 days, with complete mortality observed after 9 days.
Concurrently, Spirulina production and nutritional value (e.g., phycocyanin content) remain unaffected.
Furthermore, ammonium bicarbonate (NH₄HCO₃) concentrations exceeding 200 mg/L in culture media also inhibit rotifers. This compound likely releases ammonia compounds in water, affecting rotifer nervous systems to control reproduction.
In summary, by selecting natural inhibitors and rationally regulating culture environments, we can effectively control rotifer contamination without compromising Spirulina growth, enabling stable and safe production.
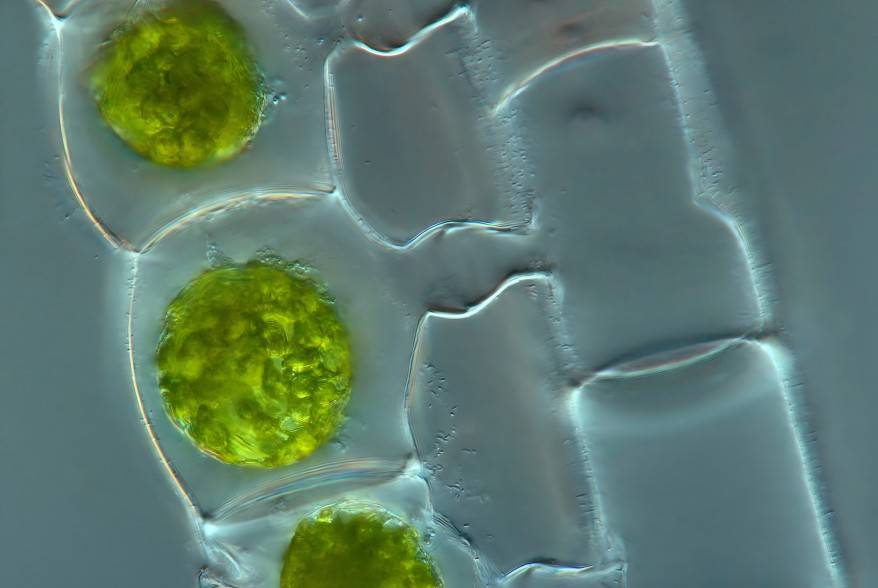
2.6 Growth Inhibitors: The “Metabolic Waste” Crisis of Spirulina
During cultivation, spirulina produces “metabolic waste” similar to humans. These substances primarily include large-molecule polysaccharides secreted by the algae and amines generated from decomposing dead algal bodies. Not only do they severely inhibit spirulina's own growth, but if directly discharged into natural water bodies, they can also cause aquatic plant death, trigger algal blooms, and create environmental problems.
When reusing old culture medium containing these inhibitors, spirulina growth stalls:
· Growth rate decreases by 23%
· Nutrient absorption capacity drops by over 35%
· Protein content reduces by 15%
· Chlorophyll content diminishes by 35%
Why are these “waste products” so harmful?
· Causing cells to “clump and sink”: Inhibitors increase surface hydrophobicity, leading to cell flocculation and settling at the bottom.
· Weakening photosynthesis: Reduced chlorophyll content directly impacts energy synthesis.
· Lowering enzyme activity: Decreased activity in antioxidant systems and nitrate reductase disrupts normal metabolism.
· Attract other microorganisms: These substances provide nutrients for other contaminants, leading to pollution.
Solution: Give the culture medium a “bath.” To increase reuse rates and reduce contamination, two common methods are currently used:
· Membrane filtration technology: Utilizes ultrafiltration membranes (e.g., 100 kDa) to remove macromolecules. Experiments show filtered medium boosts spirulina growth by 30%, approaching the effectiveness of fresh medium.
· Adsorption method: Treatment with macroporous adsorption resins (e.g., S-8) effectively removes 62% of polysaccharides, boosting spirulina growth rate by 39.4%.
In the future, developing technologies to extract valuable products (e.g., extracellular polysaccharides, proteins) from spent media will not only reduce contamination but also transform waste into resources, enabling green and sustainable development in the spirulina industry.
2.7 Trace Elements: Spirulina's “Vitamins”
Just as our health depends on various vitamins and minerals, spirulina's growth is significantly influenced by trace elements like selenium, zinc, copper, and manganese. Though required in minimal quantities, these elements exert a disproportionately large impact.
Interestingly, spirulina possesses a natural “enrichment” capacity, absorbing and concentrating metallic elements from water. Low concentrations of trace elements can stimulate its growth, even enabling the cultivation of spirulina with specialized properties (e.g., selenium-enriched). However, excessively high concentrations disrupt cellular structures, generate toxicity, and prevent normal spirulina growth.
Selenium: A Prime Example
Selenium is an essential trace element for the human body, serving as a component of vital enzymes that support normal metabolism and disease prevention. Spirulina can convert inorganic selenium into more bioavailable organic forms (like selenoproteins), making selenium-enriched spirulina an ideal natural selenium supplement source.
2.8 Other Influencing Factors: Environment, Nutrition, and “Diet”
Beyond the previously mentioned factors, spirulina's growth and nutritional composition are also meticulously influenced by the cultivation environment, nutrient formulation, and even ‘vitamin’ content. It can be said that cultivating high-quality spirulina hinges on attention to detail.
Cultivation Environment Matters Research shows spirulina exhibits vastly different growth states in different “houses.”
영양Formulation is Core Technology Much like preparing nutritionally balanced meals for humans, the “recipe” for spirulina—its culture medium—is critic알다.Each mineral serves a distinct function:
· Magnesium (Mg²⁺): Activates enzymes and promotes polysaccharide synthesis.
· Potassium (K⁺) and Sodium (Na⁺): Maintain normal osmotic pressure inside and outside cells, preserving cellular health.
Through scientific experimentation, researchers have even identified a “golden formula” containing optimal ratios of components like sodium bicarbonate, sodium nitrate, and potassium dihydrogen phosphate, maximizing both yield and quality of spirulina.
Trace “vitamins” play a major role. Even minute amounts of vitamins can influence spirulina growth. For instance, extremely low concentrations (0.1–5 mg/L) of vitamin B5 promote growth, with optimal effects at 0.5 mg/L,leading to peak phycocyanin content after 9 days of cultivation.
Seawater vs. Freshwater: Which is Better? Interestingly, spirulina cultivated in seawater typically exhibits significantly higher levels of polyunsaturated fatty acids and chlorophyll compared to freshwater-cultivated strains.
Scientists speculate possible reasons include:
· Seawater provides richer mineral nutrition;
· Seawater offers better buffering capacity and more stable pH levels;
· Seawater inherently contains higher CO₂ concentrations.
However, the specific mechanisms at play require further investigation. This also opens intriguing avenues for future spirulina cultivation.

3 Summary and Outlook: Spirulina's Future—Opportunities and Challenges Coexist
Spirulina, this blue-green microalgae hailed as an “underwater superfood,” is gaining global popularity among health enthusiasts for its remarkable nutritional value. Though minuscule, it contains up to 60%-70% high-quality protein, abundant vitamins, minerals, and antioxidants—particularly unique bioactive compounds like phycocyanin—securing its perennial position among top superfoods. Not only do vegetarians regard it as a natural protein treasure trove, but health-conscious individuals increasingly favor it for its immune-boosting, antioxidant, and anti-inflammatory properties.
As modern living standards and health awareness continue to rise, market demand for spirulina is growing significantly. It has found widespread application in health supplements, plant-based protein products, functional beverages, and even skincare, emerging as a “green powerhouse” in daily nutrition and wellness management. Learn More About Our One-Stop Solution for Compliant and Consistent Spirulina Extract Ingredients.
참조:
[1]Shi W Q, 리 S D, 리 G R, et 알다. 수사 에 영향을 미치는 주요 요인의 성장률 스 피 루 리나의 [J]다. Optik-International Journal for Light and Electron Optics, 2016년,127(16):6688-6694, DOI:10.1016/j.ijleo.2016.04.125.
[2] Vonshak 한,Richmod A. Mass Production of the Blue-green Alga Spirulina: 한 개요 [J]다. 바이오 매스, 1988년, 15 (4): 233-247, DOI:10.1016/0144-4565 (88) 90059-5.
[3] Wang Z J, 장 X W. 억제 효과 of 작은 분자 펩 티 드 from Spirulina (Arthrospira) platensis on 암 세포 성장 [J]다. 음식 Funct다., 2016년, 7 (2): 781-788, DOI:10.1039/C5FO01186H.
[4] Ozyurt G, Uslu L, Yuvka I, et 알다.평가of the Cooking Quality Characteristics 의 파스타 농축 with 스 피 루 리나 platensis [J]다. J.Food Qual., 2015, 38(4):268-272, DOI:10.1111/Jfq.12142.
[5]Jafari SM한,랍바니 M,엠티 아쥬 M, et al.식이 스 피 루 리나 platensis가 무지개의 지방산 조성에 미치는 영향 송어 (Oncorhynchus mykiss) 살코기 [J.한국수산학회, 2014, 22(4):1307-1315
[6] Wu Q H, 류 L, 마이 런 한, et al. The 항산화, 면역 odulatory 및 항염증 활성 ofSpirulina:An 개요 [J]다. 아치다. Toxicol다., 2016, 90: 1817-1840, DOI:10.1007/S00204-016-1744-5.
[7] Yu J, Hu Y L, Xue M X, 외.항산화 물질의 정제 및 식별 펩 티 드 from 효소 Hydrolysate of Spirulina platensis [J]다.j. MicrobiolBiotechnol다., 2016, 26(7): 1216-1223, 도이:10.4014/Jmb.1601.01033.
[8] Ali H E A, Shanab S M, Abo-State M A, et al. Evaluation 의 항 산화 물질이 풍부 하여, 색소 and 보조 대사 물질 내용 Spirulina platensis) [J.한 기초이다.체다.다., 2014, 625:160-163.
[9]Khan Z, Bhadouria P, Bisen P S. Nutritional and 치료 잠재적인 of Spirulina [J]다. Curr다. 광동 제약이다. Biotechnol다., 2005년, 6 (5):373-379.
-
Prev
Spirulina Extract: A High-Protein Natural Colorant for Clean-Label, Healthy Products
-
다음
Green Spring Technology: Your One-Stop Natural Ingredient Solution with Spirulina Extract


 영어
영어 프랑스
프랑스 스페인
스페인 러시아
러시아 한국
한국 일본
일본




