강황가루의 약용도는 무엇인가요?
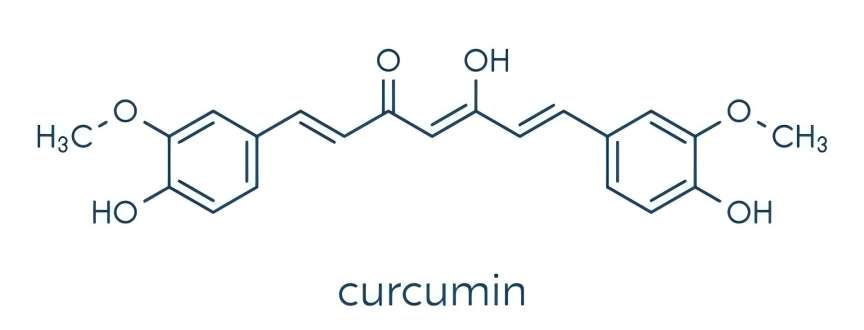
커 is a natural phenolic active ingredient 에서the rhizome 의turmeric 그리고is the ma에서phenolic substance extracted 에서the rhizome 의turmeric. Turmeric can be divided into three curcuminoids, namely bisdemethoxycurcumin, demethoxycurcumin 그리고ferulic acid methyl ester (Figure 1). The three curcuminoids have similar structures and similar pharmacological effects, including antibacterial, antioxidant, anti-apoptotic, anti-tumor and anti-metastasis effects [1,2]. Turmeric is used as an herbal remedy for a variety 의ailments [3] and is also used as a spice, food coloring and preservative. Curcumin is not only used as an anti-inflammatory agent, but also to treat gastrointestinal disorders such as indigestion, flatulence, diarrhea and stomach and duodenal ulcers [4,5].
1 curcumin의 화학 성분
커큐민 (Curcumin)은 다이케톤 구조를 가진 폴리페놀성 화합물이다.그것이 포함 되어 있 특별 한 1, 7-dioxane 해골과 두 o-methylated으로 이루어 졌고 β-diketone 페놀이다.커큐민 분자 내에 페놀성 하이드록시기, 카보닐기 및 이중결합과 같은 여러 활성 그룹이 존재하기 때문에 커큐민의 화학적 특성은 비교적 활발합니다.커큐민의 항산화성이 더 강해진 것은 o-메톡시와 디케토포롤 (diketophorol) 사이의 전이금속의 킬레이션 때문인 것으로 보고되었다 [6].커큐민은 케토 (keto)와 에놀 (enol) 형태의 두 가지 오토머를 포함하고 있다.전자는 고체 및 액체 단계에서 모두 안정적이며 색상은 적갈색으로 나타납니다;후자의 생물 학적으로 활성 성분은 디케톤 1,7-비스 (4-히드 록시-3-메 톡시 페닐)-1,6-헵타 디엔-3,5-디온의 형태로 산성 및 중성 조건에서 존재하며 밝은 노란색으로 보이므로 화학 산 지시약으로 사용할 수 있습니다 [7,8].
연구에 따르면, 그 결과 curcumin can exert a variety of beneficial effects in the gastrointestinal tract, such as preventing reflux esophagitis, Barrett's 식도, 그리고 비스테로이드성 항염증제 (NSAID)로 유발된 위 점막 손상.커큐민은 p23과 인체 표피 성장 인자 수용체 2와 같은 다양한 발암 인자의 증식과 위암 세포의 침입을 막을 수 있습니다.최근 커큐민은 산화스트레스와 위염, 위궤양, 위암 등 염증 관련 질환 치료에 상당한 관심을 받고 있다.또한 커큐민은 동맥경화증, 당뇨병, 심혈관 질환, 만성 신장 질환 등 노화 관련 질환 개선에도 사용할 수 있다.강황 유도체는 관절염, 포도막염, 염증성 장 질환 [9]과 같은 만성 염증을 완화시키는 것으로 밝혀졌다.커큐민은 다양한 박테리아 [10]에 대한 광역 스펙트럼 항균 효과가 있는 강력한 항균 특성을 가진 것으로 확인되었다.커큐민은 헬리코박터 파일로리균을 단독으로 사용하거나 기존의 다른 항생제와 병용했을 때 치료에 효과가 있는 것으로 밝혀졌다.커큐민은 in vitro와 in vivo 연구 모두에서 광범위 항균제로 밝혀졌으며, [11] 보조요법으로 사용될 때 특정 항생제와 시너지 효과를 내는 것으로 밝혀졌다.
본 고찰에서는 커큐민의 화학적 성분을 분석하고 다양한 약리학적 효과를 강조하고자 한다.
2 curcumin의 약리학적 효과
2. 1 Curcumin' Helicobacter pylori에 대 한 s 효과
헬리코박터 파일로리균은 1983년에 처음 발견되었다.0.6 hm 3.5 hm 크기의 나선형의 이동성이 강한 그람음성 병원성 세균이다.헬리코박터 파일로리균은 세계보건기구에서 인정한 원핵 인체 발암물질로 [12] 1차 인체 병원균이다.중국에서 H. pylori의 감염률은 약 56%이다.위암, 소화불량, 위염, 소화성 궤양, 상부위장관 질환 [13] 등 많은 상부 위장관 질환들이 헬리코박터 파일로리균과 관련이 있다.H. pylori의 높은 병원성은 주로 urease, vacuolating cytotoxin A (VacA), cytotoxin-associated gene A (CagA) 및-glutamyl transpeptidase (HpGGT)와 같은 다양한 독성 인자 때문입니다.
2.1.1 헬리코박터 파일로리 감염
CagA는 Helicobacter pylori 단백질이며 H. pylori의 중요한 독성 인자이다.만성 H. pylori 감염시, CagA는 cag 병원성 섬 [14, 15]에 의해 암호화된 제4 형 분비계 (T4SS)에 의해 표적 세포 (예:위 상피세포)에 직접 전달된다.CagA 단백질은 진핵생물 Gab1 적응기 단백질로서 기능할 수 있으며 세포 증식 및 이동과 같은 일부 세포 내 경로 활성화를 도울 수 있다 [16, 17].숙주세포로 전달된 후, CagA는 특유의 서열 (Glu-Pro-Ile-Tyr-Ala) 에피-야 모티브 [18]에서 티로신 인산화 과정을 거친다.인산화된 CagA 단백질은 세포 신호전달 경로를 유발하고 세포 병변을 일으키는 데 매우 중요한 역할을 한다.
caga로 유발된 생물학적 활성은 산란/벌새의 표현형, 세포 간의 밀착된 결합의 파괴, 세포의 증식, 염증, 생존을 조절하는 여러 전사인자들의 활성화의 세 가지로 나눌 수 있다 [19].따라서 CagA-dependent pathways를 통해 H. pylori는 표적세포의 세포내 신호를 수정하고 감염 및 병원성을 촉진한다.따라서 H. pylori 감염은 위염을 유발하는 중요한 요인이다.
CagA 단백질의 인산화와 하류 신호전달 경로의 활성화는 CagA 단백질이 병원성 효과를 발휘하는 주요 방식이며, 인산화의 장소는 CagA 단백질 에피야 모티프의 티로신 잔류물이다.CagA 가 숙주세포에 들어가면 즉시 비수용체인 티로신 키나아제 Src에 의해 인산화되며, 감염 2~4시간 후 Src 키나아제는 결합되어 있는 인산화된 CagA 단백질의 피드백 억제에 의해 불활성화될 수 있다.이때 또다른 비수용체인 티로신 키나아제인 Abl이 활성화되어 CagA를 계속 인산화한다 [20].EPIYA의 부위별 인산화는 세포 형태 변화의 정도도 다르게 나타나는데, 이는 H. pylori 감염시 CagA의 인산화가 엄격하게 통제됨을 나타낸다.CagA와 표적 단백질의 상호작용으로 인해 이상 신호 경로가 활성화되어 [21] 세포 기능이 교란된다.
tyrosine kinase receptor encoding gene (Mesenchymal epithelial transition factor, MET)은 proto-oncogene이다.그것에 의해 암호화된 MET transmembrane receptor protein은 tyrosine kinase 활성을 가지고 있으므로 MET은 receptor tyrosine kinase 계열의 일원이다.헬리코박터 파일로리는 CagA-MET 신호전달을 통해 프로염증 및 악성 전암 반응을 유도하고 상피세포 운동을 유도하며 활성화된 MET는 어댑터 단백질로 CagA를 이용하여 CagA 인산화를 유도하여 헬리코박터 파일로리가 유도한 세포 운동을 감소시키기 위해 하류의 phospholipase C (PLC)와 MAPK 경로를 유도한다 [22].CagA는 또한 MET 신호를 비인산화한 방식으로 활성화시킬 수 있는데,이 경우 CagA의 c-말단 영역에 있는 conserved repeat phosphoinositide-independent activity (CRPIA) motif 라고 하는 conserved motif 가 활성화된 MET과 상호작용하여 PI3K/Akt 신호를 활성화시켜 세포의 이동과 운동성을 촉진시켜 궁극적으로 세포 증식과 염증 반응을 유도할 수 있다,헬리코박터 파일로리 감염 [23] 후 위암세포의 증식을 초래한다.따라서 CagA의 인산화된 형태와 비인산화된 형태 모두 MET와 상호작용하여 위암 진행시 하류 신호 경로를 자극할 수 있습니다.
또한 H. pylori 감염에 의해 유도된 MET 활성화는 위암세포를 둘러싼 면역세포에 영향을 미친다.위암세포에서의 헬리코박터 파일로리 감염은 활성 형태의 MET [24]을 함유한 엑소좀의 생산을 증가시킨다고 보고되었다.외좀은 정상적인 생리조건하에서 널리 생성되며 진핵세포간의 의사소통을 매개하는 세포외의 신호체이다.종양세포는 외소좀을 통해 IL-6, Akt, TNF-a와 같은 MET-inducing factor를 전달하여 인접한 종양세포에 MET을 유도하여 위에 발암성 효과를 유도할 수 있다.
커큐민의 항균효과 2.1.2
헬리코박터 파일로리 감염에서 커큐민의 역할은 주로 헬리코박터 파일로리 유발 nuclear factor-KB, nuclear factor-activated B 세포 K-light chain enhancement (NF-KB), activation induced 셀death (AICD), interleukin-8 (IL-8), MMP-3, MMP-9을 host 상피세포에서 억제하여 염증 반응을 예방하는 것이다 [25], 그림 2 참조.연구에 따르면 커큐민은 COX-1보다 COX-2와 TXA2에 더 효과적입니다.Curcumin은 COX-2와 TXA2의 활성을 억제할 수 있지만 COX-1의 활성에는 영향을 주지 않는다.커큐민의 항염증 효과는 cyclooxygenase (COX-1 및 COX-2), lipoxygenase (LOX), tumor necrosis factor (TNF2), interferon (IFN2) 및 inducible nitric oxide synthase (iNOS) [26]와 같은 주요 염증 매개체를 억제함으로써 얻을 수 있다.이 중 COX-2, LOX, iNOS는 염증 반응을 매개하는 중요한 효소이다 [27].연구에 따르면 curcumin은 cytosolic phospholipase A2의 인산화에 영향을 미치고 arachidonic acid 대사를 차단하여 COX-2의 발현을 감소시키는 동시에 5-LOX의 촉매 활성을 억제한다.
헬리코박터 파일로리균은 제4 형 분비계의 성분이 CagA 단백질을 위 상피세포로 수송한다.이어서 CagA 단백질은 인산화된다.이 인산화된 CagA는 숙주인 포스파타제 SHP-2와 상호작용하여 세포골격의 재배열을 일으키고 [28] 숙주세포의 형태학적 변화를 초래한다.
연구에 따르면 curcumin에 6시간 동안 노출된 H. pylori는 박테리아의 가역적인 성장 억제를 이끌어 CagA의 전이를 효과적으로 감소시킬 수 있다 [29,30].CagA의 전위를 감소시킴으로써 세포골격 재배열을 감소시켜 CagA 인산화를 거의 완벽하게 억제하도록 유도할 수 있다 [31,32].이러한 연구 결과는 H. pylori 성장에 대한 curcumin의 억제 효과와 관련이 있다.생쥐를 대상으로 한 많은 실험 연구에서 커큐민의 경구 투여가 H. pylori 감염에 의한 위염증을 현저히 억제할 수 있음이 밝혀졌다 [33,34].많은 연구들은 H. pylori에 대한 curcumin의 효과를 강조해왔다.강력한 항균 활성으로 인해 커큐민은 세균 성장을 효과적으로 억제하여 [35] 질병 치료 분야에서 H. pylori의 치료에 새로운 방법을 제공할 수 있습니다.따라서 커큐민은 H. pylori 감염의 예방과 치료에 효과적인 약물이 될 수 있다.
커큐민의 항암효과 2.2
연구에 따르면 CagA-negative H. pylori isolates에 감염된 환자와 비교하여 CagA-positive H. pylori isolates에 감염된 콜로니화는 심각한 위염, 소화성 궤양 질환 및 위암의 위험 증가와 관련이 있다고 한다 [36].헬리코박터 파일로리균은 세포 신호의 비정상적인 활성화 경로를 시작할 수 있다.인산화된 CagA는 ERK/MAPK 신호전달 경로를 활성화시킴으로써-enolase 발현의 up-regulation을 유도할 수 있다.-Enolase는 새로운 종양 관련 단백질로 종양의 무제한 증식 과정에 관여하며, 세포의 자가파지를 일으키고 위암의 발생을 유도한다 [37,38].이는 H. pylori-induced 위암cancer의 메커니즘에서 인산화된 CagA의 중요한 역할을 더 증명합니다.
커큐민의 항염증 활성은 인도메타신과 같은 비스테로이드성 항염증제 (NSAIDs)와 비슷하다.비스테로이드성 항염증제 (NSAIDs)에 의한 궤양은 위장관에서 프로스타글란딘 합성 억제와 관련된 복잡한 과정으로 위산 분비 증가, 중탄산염 점액 분비 감소, 상피 점막에 대한 영양적 효과 감소 [39] 뿐만 아니라 미세혈관 투과성 증가, 산화질소의 불균형 및 활성산소의 생성을 초래한다.이러한 항염증제는 위산 분비를 증가시키는 시클로옥시게나아제 (cyclooxygenase, COX)의 활성을 억제함으로써 프로스타글란딘 합성을 차단하여 점액 고갈을 초래하고 점막벽의 손상을 증가시킨다 [40].이들의 항염증 및 항암 특성은 COX-2, LOX 및 iNOS를 억제하고 IFN-및 TNF-와 같은 사이토카인을 생성하며 NF-KB 및 AP-1과 같은 전사인자를 활성화함으로써 매개된다 [41,42].따라서 COX-2전사에 관여하는 신호 경로를 방해하는 약물은 염증과 종양의 발생도 줄일 수 있다.
이상의 연구에서 LOX 경로의 아라키돈산 대사산물이 성장 관련 신호 전달에 중요한 역할을 한다는 것이 밝혀졌으며, 이는 이러한 경로의 중재가 암의 진행을 막는 데 유용해야 한다는 것을 의미한다 [43].커큐민은 activator protein (AP-1)과 nuclear factor KB (NF-B)에 의해 활성화된 유전자의 발현을 조절함으로써 강력한 항산화 및 항암성을 나타낸다.염증은 종양 촉진과 밀접한 관련이 있기 때문에 커큐민은 강력한 항염증 특성 [44]으로 인해 암 발생에 화학 예방 효과를 발휘할 것으로 기대된다.커큐민의 잠재적인 항암 기전은 NF-KB와 COX-2의 억제 (COX-2의 상승된 수준은 다양한 암과 관련이 있음);이 경로에서 생성되는 활성산소를 제거하는 lipoxygenase를 통한 아라키돈산 대사 억제;감소로 인한 암 세포 성장의 억제의 표현 같은 염증 성 cytokines IL-1 β, IL-6와 TNF-;그리고 단백질 키나아제 C [45]와 같이 염증과 종양세포 증식을 매개하는 효소들을 하향조절한다.따라서 커큐민은 여러 신호 경로를 통해 종양 성장을 예방, 억제하고 종양 세포의 사멸을 촉진 할 수 있습니다.
커큐민의 항산화 효과 2.3
커큐민은 효과적인 항산화제입니다상부 소화관과 질소 화합물의 청소부 [46,47]에서.curcumin의 항산화 효과는 주로 활성 산소 활성산소의 제거, 지질 과산화 억제, superoxide dismutase (SOD) 및 catalase (CAT)의 활성 증가 등에 반영되며 레시틴 지질 과산화 및 유도 DNA 산화적 손상에 상당한 억제 효과가 있습니다.헬리코박터 파일로리균은 염증 매개체를 통해 위 손상을 일으키며, 이로 인해 다량의 산소 활성산소와 반응성 산소종이 생성된다.리소솜 막이 파열된 후, 보디 's 가수분해효소가 세포 내로 방출되어 세포 전체가 가수분해되고 위 상피세포에 손상을 입힌다 [48].이러한 손상은 위점막의 정맥과 동맥의 수축으로 이어져 충혈, 염증, 조직손상을 초래할 수 있다.실험결과, 쥐에서 인도메타신 유발 위점막 손상에 대한 커큐민의 보호효과는 커큐민을 매개로 한 pro-inflammatory cytokine (IL-6, TNF-) 발현의 down-regulation에 의존하며, 조직학적 손상은 현저히 감소되는 것으로 나타났다.
Among them, curcumin inhibits apoptosis and increases mucosal epithelial resistance, there에 의해increasing gastric mucosal cell differentiation. Curcumin is a unique antioxidant containing many functional groups, including phenolic hydroxyl groups, methoxy groups and 1,3-β-diketones, as determined 에 의해chemical structure analysis. Curcuminoids can undergo nucleophilic addition via various complex mechanisms, which confers their antioxidant properties [49,50]. Curcumin is unstable under alkaline conditions, but its stability increases significantly under acidic conditions. In an in vivo study, curcumin was compared with lansoprazole, a proton pump inhibitor (PPI) that is the recommended standard drug for the treatment of gastrointestinal diseases such as gastroesophageal reflux disease (GERD) [51]. It was found that curcumin can effectively prevent the formation of acute mixed reflux esophagitis, reduce neutrophil infiltration, and reduce its severity. Although curcumin is less effective than the proton pump inhibitor (PPI) lansoprazole in inhibiting acid reflux esophagitis, it is effective in preventing bile acid reflux esophagitis. This protective mechanism of curcumin in the esophagus can be attributed to the antioxidant properties of curcumin.
3 결론
Analysis of the chemical structure and pharmacological effects of curcumin shows that it has anti-inflammatory, anti암and antioxidant biological effects. As research continues, the overall efficacy of curcumin in treating various diseases such as gastric inflammation and 암is expected to be promising. The role and mechanism of curcumin powder in the development and progression of diseases will provide new ideas for the prevention and treatment of various diseases, which is of great significance for the diagnosis and prevention of diseases.
참조:
[1] 류 W H, 위안 J B, 장 F 외.Curcumin은 pro-liferation을 억제하고, wnt3a/p-catenin/EMT 신호경로를 통한 위암세포의 이동과 침입 [J.China 저널of Chinese Materia Medica, 2019년,44(14):3107-3115.
[2] 아이비 B R, 줄리아 S V, 칼라 V G 등.Helicobacter pylori에 감염된 환자에서 IL-6, IL-8, IL-10 유전자의 다형성과 위병리의 위험성 (the risk ofgastric pathology in patients infected with Helicobacter pylori)Journal of micro-biology, Immunology and Infection, 2017, 50(2):153-159.
[3] HE C Y, CHEN M Y, LIU J Y 등.숙주 유전인자 re-spond to 병원성 step-specific virulence factors of Helico-bacter pylori in gastric carcinogenesis[J]. < li > 「 Mutation Research-Reviews in Mutation Research 」, 2014, 759(1):14-26.
[4] NANJUNDASWAMY S, JAYASHANKAR J, RENGANA-보다 R R A, 외.MRSA에 대한 치명적인 무기로 Pyridine과 pyrazole 유사체를 결합:in vitro and in silico approach [J].미생물 병원성, 2022, 166:105508.
[5] 나우만 M, 소콜로바오, 테그트마이어 N 등.헬리-코박터 파일로리 (heli-cobacter Pylori):숙주세포 sig-nal transmission을 전복하기 위한 패러다임 병원균 [J.마이크로비올지의 동향, 2016, 25(4):316-328.
[6] 사나이엠 J, 쉬르자드 H, 솔타니 A 외.상향 조절된 CCL18, CCL28 및 CXCL13발현은 헬리코박터 파일로리 감염에서 위염 및 위궤양 질환의 위험과 관련이 있다 [J].The American Journal of The Medical Sciences, 2020, 361(1):43-54.
[7] GORGIEVAO S, TRCEK J. Bacterial cellulose:production, modification and perspectives in biomedical applications (J.나노소재, 2019년,9(10):1352.
[8] WANG J, TAVAKOLI J, TANG Y. Bacterial cellulose produc-tion, properties and applications with different culture methods-a review[6].탄수화물 중합체, 2019, 219:63-76.
[9] KHAN H, KADAMA, DUTT D. Studies on bacterial cellulose produced by a novel strain of Lactobacillus 속 [J].carbohy-drate 고분자, 2020, 229(22):115513-115523.
[10] CHENG H, XU T. Macrophage polarization in the develop-ment and progression of ovarian cancers:an overview[J].Fron-tiers in 종양 학,2019, 9:421 쪽.
[11] RUFFELL B, COUSSENS L M. Macrophages and therapeutic resistance in cancer (J.암세포, 2015, 27(4):462-472.
[12] BISWAS S K, MANTOVANI a. Macrophage 가소성과 iymphocyte subsets 와의 상호작용:cancer as a paradigm[J].Nature Immunology, 2010, 11(10):889-896.
[13] 조 X, 첸 J,리 B 외.효과적인 대식세포 기반 암 면역치료를 위한 항체 의존성 세포 식세포 증식 촉진 [J.Science Advances, 2022, 8(11):l91-201.
[14] WENG WH, GoelA.Curcumin and colorectal cancer:An up-date and current perspective on this natural medicine[J] (커큐민과 대장암).「 sem-inars in Cancer Biology 」, 2022, 80:73-86.
[15] 투르치 R, 토르토리치 F, 모니카 B 외.저 유황 아미-아니 산,고다 불포화 지방산 식단은 유방암 성장을 억제합니다 [J].International Journal of Molecular Scien-ces, 2022, 24(1):249.
[16] LIM, GUO T, LIN J 외.Curcumin은 Hedgehog/Gli 1 신호전달 경로 [J]를 통해 삼중음성 유방암의 침범과 전이를 억제한다.한국민족약리학회지, 2022, 283:114689.
[17] 왕엔 Z, 펑 T, 류 X N 등.Curcumin은 mi-gration을 억제합니다 and 침략 of 비소 cell 폐 cancer miR-206의 up-regulation과 PI3K/AKT/mTOR 신호전달 경로 억제를 통한 세포 [J.Acta 제약학, 2020, 70(3):399-409.
[18] 가세미 F, 샤피에 M, 자린 S 외.자궁경부암세포에서 Curcumin in-hibits NF-kB와 Wnt/p-catenin 경로 [J. Pathology-Research 과 연습, 2019, (영어) 215 (10):152556.
[19]다 W, 장 J, 장 R 외.Curcumin은 mphangiogenesis를 억제합니다 of gastric cancer 세포 by inhibiton HMGB1/VEGF-D 신호 [J]의.임-무 opathology and Pharmacology 국제학술지, 2019,33:3107-3115.
[20] 콘체 A, 비글라리아노, 파나히이 외.소화성 궤양에 대한 curcumin 과의 겸용요법:무작위 대조-주도 시험 [J].약물연구, 2016, 66(8):444-448.
[21] JIANG C, LUO P. Nrf2/ARE는 커큐민-매개에 대한 핵심 경로이다 보호 TMJ의 chondrocytes from 산화 스트레스와 염증 [J.「 Cell Stress and Chaperones 」, 2020, 25(3):395-406.
[22] 장 X리 S, 아이유 X 외.Curcumin은 세포의 생존성을 억제하고 미추형 Homeobox-2 (CDX2)/Wnt/-catenin 경로를 통해 SW620인간 대장선암-종세포의 apoptosis를 증가시킨다 [J].Medical Science Monitor:국제 의료 Journal of 실험적 and 임상 연구, 2019, 25:7451-7458.
[23] KWIECIEN S, MAGIEROWSKI M, MAJKA J 외.curcu-min:식도 및 위 disor-ders [J]에 대한 강력한 보호제.International Journal ofMolecular Sciences, 2019, 20 (6):1477.
[24] LATHAM A, SRINIVASAN P, KEMEL Y. Microsatellite in-안정성은 린치 증후군 범암 [J]의 존재와 관련이 있다. 임상 저널 (Journal of Clinical) Oncology, 2019, 『 한국정치학회보 』 37 (4):286-295.
[25] LIU J, ZHANG J, REN L 등.에 있는 미세 입자성 물질들은 ATM/P53/CDK2와 미토콘드리아 ap를 통한 사멸을 유혹한다 경로 트리거 by 산화 스트레스 in 쥐 그리고 GC-2spd 세포 [J. 생태독성학과 환경안전, 2019, 180:280-287.
[26] YU Y T, TIAN L Q, XIAO Y Y 등.비타민 D 보충이 제2 형 당뇨병 대상자의 일부 염증성 바이오마커에 미치는 영향:무작위 대조군 임상시험의 체계적 고찰 및 메타애널리시스 (J).Annals ofNutrition and Metabolism, 2018, 73(1):62-73.
[27] NI Y, NI L, ZHU F 등.지방 yissue 대식세포 pheno-종류와 특성:비만과 대사장애에서 인슐린 저항성의 핵심 [J.대한비만학회지, 2020, 28(2):225-234.
[28] JEFFRY A, ANDREW M J, BODDY AV. Curcumin as A cli-nically-promising anti-cancer agent:pharmacokinetics and drug interactions[J].Expert Opin on Metabolism and Toxicology, 2017, 13(9):953-972.
[29] 장 J L, 장 J, 장 R 외.당뇨병성 신증 중국인 환자에서 im-munoglobulin G depositin glomeruli의 의미 (J. Clinical and Experimental Pharma-cology and Physiology, 2020, 47(6):919-926.
[30] FENG J, LU S Y, OU B 외.ofJNK signaling pat-hway in obesity-driven insulin resistance[J]의 역할.당뇨병, 대사증후군 및 비만:대상과 치료, 2020, 1399-1406.
[31] XIAO H, KANG S. The role ofthe gut microbiome in energy balance with a focus on The gut-지방조직axis[J] (장내 미생물 군집).fronti-ers in Genetics, 2020, 11(7):297.
[32] HERSOUG L, MOLLER P, LOFT S. 역할 microbiota-de-rived lipopolysaccharide in adipose tissue 비만시 팽창작용, 지방세포 크기 및 화농증 [J.영양재-검색리뷰, 2018, 31(2):153-163.
[33] RACHDAOUI N. 인슐린:the friend and the foe in the devel-opment oftype 2 diabetes mellitus[J].International Journal of Molecular Sciences, 2020, 21(5):1770.
[34] 모하메드 A, 바히데 HZ.IL-6 신호경로와 제2 형 당뇨병의 발생.Inflflammopharmacology, 2018, 26(3):685-698.
[35] AKASH M SH, REHMAN K, Liaqat A. Tumor necrosis fac-tor-α:role in development of 인슐린 저항성 및 pat-hogenesis of type 2 diabetes mellitus[J].한국세포생화학회지, 2018, 119(1):105-110.
[36] 볼프 C M O, 비야르 D, 폴라 M 외.세포 사망, reactive oxygen species (ROS) 및 당뇨병성 합병증 [J].「 세포죽음과 질병 」, 2018, 9(2):119.
[37] WANG J, WANG H. Oxidative stress in 췌장 베타세포 재생 (J.산화의학과 세포장수, 2017, 120(9):193-201.
[38] 헤사리 AR, 미트라 A, 알리레자 S 외.Chemopreven-curcumin in esophageal can-cer:current and future status[J] 식도캔에서 curcumin의 항암성 및 치료적 잠재성.국제암학회지, 2019, 114(6):1215-1226.
[39] KARBALAEI M, TALEBI B. Helicobac-ter pylori에서 CagA 및 VacA s1m1 현황과 항생제 내성 (Clinical relevance ofthe CagA and VacA s1m1 status and antibiotic resistance in Helicobac-ter pylori:a systematic review and meta-analysis[J].BMC in-fectious Diseases, 2022, 22(1):573.
[40] 커버는 T L, LACY D B, OHI M D. The Helicobacter pylori cag type IV secretion system[J].미생물학동향, 2020, 28(8):682-695.
[41] UMAR B, ROUTHUN K, KUMAR A. Multifaceted roles of plant derived small molecule inhibitors on replication cycle of SARS-CoV-2[J].미생물 병원성, 2022, 168:105512.
[42] KARKHAN A. Helicobacter pylori evasion strategies of the host innate and adaptive immune responses to survive and de-velop gastrointestinal diseases (J.미생물연구 (Microbiological Research), 2018, 218:49-57.
[43] MENTIS A, BOZIKI M, GRIGORIADISN.Helicobacter blood-lori 감염과 위암 생물학:tempering a double-날의 검 세포 [J]. 세포분자생명과학, 2019, 76(13):2477-2486.
[44] 페레이라 M J. 헬리코박터 파일로리 (Helicobacter Pylori) 감염, 위 마이크로바이옴과 위암 [J.Experimental Medicine and Biology의 발전, 2019, 1149:195-210.
[45] 탱 X Q, 비, 풍 J Q 외.저항성 인체위에서의 curcumin이 mul-tidrug 저항성에 미치는 영향 암 셀 라인 SGC7901/VCR[J].Acta Pharmacologica Sinica, 2005, 26(8):1009-1016.
[46] PIWOCKA K, BIELAK M A, EWA S. Curcumin은 cas-pase-3-independent을 유도한다 인간의 사멸 multidrug-resistant 세포다 [J다]뉴욕 과학 아카데미 Annals, 2002, 973:250-254.
[47] PAL S, TANYA D, GAURISANKAR S. Curcumin은 세포주기의 G2단계에서 seregulated cyclin d1로 발현된 세포에서 p53의존적인 방법으로 선택적으로 세포사멸을 유도한다 [J].Journal of Biological Chemistry, 2005, 280(20):20059-20068.
[48] CHEN Y, KUO T C. 대장암세포에서 curcu-min에 의한 Ca(12) 이온과 세포 p53단백질의 변조에 의한 HSP70 유전자 발현 유도 [J.Molecular Carcinogen-esis, 1996, 17(4):224-234.
[49] 카토 K, 이토 H, 카메이 K 등.stress의 자극-curcumin에 의한 stress 단백질의 wxpression을 배양세포와 생쥐조직에서 유도함 [J.「 Cell Stress and Chaperones 」, 1998, 3(3):152-160.
[50] SUNDAR D K S, HOURELD N N, MHEIDI A 등.노화 관련 질환 치료에 있어 thera-peutic 잠재력과 최근 curcumin의 발전 [J].분자, 2018, 23(4):835.


 영어
영어 프랑스
프랑스 스페인
스페인 러시아
러시아 한국
한국 일본
일본



